Химические свойства основных классов неорганических соединений. Оксиды, кислоты, основания, соли
Кислотные оксиды
- Кислотный оксид + вода = кислота (исключение — SiO2)
SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4 - Кислотный оксид + щелочь = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O - Кислотный оксид + основный оксид = соль
CO2 + BaO = BaCO3
SiO2 + K2O = K2SiO3
Основные оксиды
- Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH - Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O - Основный оксид + кислотный оксид = соль
MgO + CO2 = MgCO3
Na2O + N2O5 = 2NaNO3
Амфотерные оксиды
- Амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
ZnO + H2SO4 = ZnSO4 + H2O - Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2 + H2O (Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al2O3 + 2NaOH = 2NaAlO2 + H2O (Правильнее: Al2O - Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3 - Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)2
Кислоты
- Кислота + основный оксид = соль + вода
2HNO3 + CuO = Cu(NO3)2 + H2O
3H - Кислота + амфотерный оксид = соль + вода
3H2SO4 + Cr2O3 = Cr2(SO4)3 + 3H2O
2HBr + ZnO = ZnBr2 + H2O - Кислота + основание = соль + вода
H2SiO3 + 2KOH = K2SiO3 + 2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O - Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH)3
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O - Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO3 = CaBr2 + H2O + CO2
H2S + K2SiO3 = K2S + H2SiO3 - Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Zn = ZnCl2 + H2
H2SO4 (разб.) + Fe = FeSO4 + H2
Важно: кислоты-окислители (HNO3, конц. H
Амфотерные гидроксиды
- Амфотерный гидроксид + кислота = соль + вода
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Be(OH)2 + 2HCl = BeCl2 + 2H2O - Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O - Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Щелочи
- Щелочь + кислотный оксид = соль + вода
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O
2NaOH + CO2 = Na2СO3 + H2O - Щелочь + кислота = соль + вода
3KOH + H3PO4 = K3PO4 + 3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O - Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na2ZnO2 + H2O (Правильнее: 2NaOH + ZnO + H2O = Na2[Zn(OH)4]) - Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4] - Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3KOH + FeCl3 = Fe(OH)3 + 3KCl - Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2KOH + 2Al + 6H2O = 2K[Al(OH)4] + 3H2
Соли
- Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H2CO3) - Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO3)2 + K2S = PbS + 2KNO3
СaCl2 + Na2CO3 = CaCO3 + 2NaCl - Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3 - Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Возможно, вам также будут интересны другие разделы справочника по химии:
Методы получения основных классов неорганических соединенийНазвания некоторых неорганических кислот и солей
www.repetitor2000.ru
Основания. Химические свойства и получение
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Основания – сложные вещества, которые состоят из катиона металла Ме+ (или металлоподобного катиона, например, иона аммония NH4+) и гидроксид-аниона ОН—.
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания. Также есть неустойчивые основания, которые самопроизвольно разлагаются.

1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только
основный оксид + вода = основание
Например, оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий), кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например, калий реагирует с водой очень бурно:
2K0 + 2H2+O → 2K+OH + H20
3. Электролиз растворов некоторых солей щелочных металлов. Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
либо
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например, гидроксид меди (II) взаимодействует с сильной соляной кислотой:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
Cu(OH)2 + CO2 ≠
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например, гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
2Fe(OH)3 = Fe2O3 + 3H2O
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например, гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4Fe+2(OH)2 + O20 + 2H2O → 4Fe+3(O-2H)3
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли, а в растворе – комплексные соли.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например, при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
NaOH + Al(OH)3 = NaAlO2 + 2H2O
А в растворе образуется комплексная соль:
NaOH + Al(OH)3 = Na[Al(OH)4]
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (как правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
либо:
щёлочь + кислотный оксид(избыток) = кислая соль
Например, при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
2NaOH + CO2 = Na2CO3 + H2O
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе, при условии, что в продуктах образуется газ или осадок. Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Например, гидроксид натрия взаимодействует с сульфатом меди в растворе:
Cu2+SO42- + 2Na+OH— = Cu2+(OH)2—↓ + Na2+SO42-
Также щёлочи взаимодействуют с растворами солей аммония.
Например, гидроксид калия взаимодействует с раствором нитрата аммония:
NH4+NO3— + K+OH— = K+NO3— + NH3↑ + H2O
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид, взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла.
Например, избыток сульфата цинка реагирует в растворе с гидроксидом калия:
ZnSO4 + 2KOH = Zn(OH)2↓ + K2SO4
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей. Таким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
ZnSO4 + 4KOH = K2[Zn(OH)4] + K2SO4
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например, гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
KHSO3 + KOH = K2SO3 + H2O
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
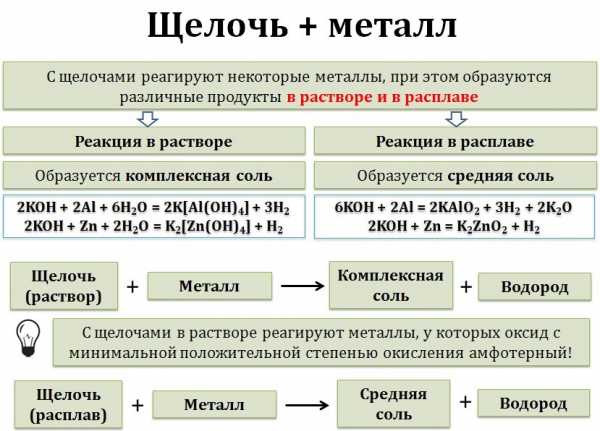
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH +Si0 + H2+O= NaCl— + Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Поделиться ссылкой:
chemege.ru
Химические свойства оксидов — урок. Химия, 8–9 класс.
1. Основные оксиды, образованные щелочными и щелочноземельными металлами, взаимодействуют с водой, образуя растворимое в воде основание — щёлочи.
Основный оксид + вода → основание.
Например, при взаимодействии оксида кальция с водой образуется гидроксид кальция:
CaO+h3O→Ca(OH)2.
2. Основные оксиды взаимодействуют с кислотами, образуя соль и воду.
Основный оксид + кислота → соль + вода.
Например, при взаимодействии оксида меди с серной кислотой образуются сульфат меди и вода:CuO+h3SO4→CuSO4+h3O.
3. Основные оксиды могут взаимодействовать с оксидами, принадлежащими к другим классам, образуя соли.
Основный оксид + кислотный оксид → соль.
Например, при взаимодействии оксида магния с углекислым газом образуется карбонат магния:
MgO+CO2→MgCO3.
Химические свойства кислотных оксидов
1. Кислотные оксиды могут взаимодействовать с водой, образуя кислоты.
Кислотный оксид + вода → кислота.
Например, при взаимодействии оксида серы(\(VI\)) с водой образуется серная кислота:
SO3+h3O→h3SO4.
Обрати внимание!
Оксид кремния SiO2 с водой не реагирует.
2. Кислотные оксиды взаимодействуют со щелочами, образуя соль и воду.
Кислотный оксид + основание → соль + вода.
Например, при взаимодействии оксида серы(\(IV\)) с гидроксидом натрия образуются сульфит натрия и вода:
SO2+2NaOH→Na2SO3+h3O.
3. Кислотные оксиды могут реагировать с основными оксидами, образуя соли.
Кислотный оксид + основный оксид → соль.
Например, при взаимодействии оксида углерода(\(IV\)) с оксидом кальция образуется карбонат кальция:CO2+CaO→CaCO3.
Химические свойства амфотерных оксидов
1. Амфотерные оксиды при взаимодействии с кислотой или кислотным оксидом проявляют свойства, характерные для основных оксидов. Так же, как основные оксиды, они взаимодействуют с кислотами, образуя соль и воду.
Например, при взаимодействии оксида цинка с соляной кислотой образуется хлорид цинка и вода:
ZnO+2HCl→ZnCl2+h3O.
2. Амфотерные оксиды при взаимодействии со щёлочью или с оксидом щелочного или щелочноземельного металла проявляют кислотные свойства. При сплавлении их со щелочами протекает химическая реакция, в результате которой образуются соль и вода.
Например, при сплавлении оксида цинка с гидроксидом калия образуется цинкат калия и вода:
ZnO+2KOH→K2ZnO2+h3O.
Если же с гидроксидом калия сплавить оксид алюминия, кроме воды образуется алюминат калия: Al2O3+2KOH→2KAlO2+h3O.
www.yaklass.ru
Классификация неорганических соединений (химические свойства классов веществ)
Неорганические вещества бывают простыми и сложными. Простые вещества делятся на металлы (K, Na, Li) и неметаллы (O, Cl, P). Сложные вещества делят на оксиды, гидроксиды (основания), соли и кислоты.
Оксиды
Оксиды — соединения химического элемента (металла или неметалла) с кислородом (степень окисления -2), при этом кислород связан с менее электроотрицательным элементом.
Выделяют:
1. Кислотные оксиды — оксиды, проявляющие кислотные свойства. Образованы неметаллами и кислородом. Примеры: SO3, SO2, CO2, P2O5, N2O5.
2. Амфотерные оксиды — оксиды, которые могут проявлять как основные, так и кислотные свойства (такое свойство называется амфотерность). Примеры: Al2O3, CrO3, ZnO, BeO, PbO.
3. Основные оксиды — оксиды металлов, при этом металлы проявляют степень окисления +1 или +2. Примеры: K2O, MgO, CaO, BaO, Li2O, Na2O.
4. Несолеобразующие оксиды — практически не вступают в реакции, не имеют соответствующих кислот и гидроксидов. Примеры: CO, NO.
Химические свойства основных оксидов
1. Взаимодействие с водой
В реакцию вступают только оксиды щелочных и щелочноземельных металлов, гидроксиды которых образуют растворимое основание
основной оксид + вода → щелочь
K2O + h3O → 2KOH
CaO + h3O → Ca(OH)2
2. Взаимодействие с кислотой
основной оксид + кислота → соль + вода
MgO + h3SO4 → MgSO4 + h3O
Na2O + h3S(изб) → 2NaHS + h3O
MgO(изб) + HCl → Mg(OH)Cl
3. Взаимодействие с кислотными или амфотерными оксидами
основной оксид + кислотный/амфотерный оксид → соль
При этом металл, находящийся в основном оксиде, становится катионом, а кислотный/амфотерный оксид становится анионом (кислотным остатком). Реакции между твердыми оксидами идут при нагревании. Нерастворимые в воде основные оксиды не взаимодействуют с газообразными кислотными оксидами.
BaO + SiO2 (t)→ BaSiO3
K2O + ZnO (t)→ K2ZnO2
FeO + CO2 ≠
4. Взаимодействие с амфотерными гидроксидами
основной оксид + амфотерный гидроксид → соль + вода
Na2O + 2Al(OH)3 (t)→ 2NaAlO2 + 3h3O↑
5. Разложение при температуре оксидов благородных металлов и ртути
2Ag2O (t)→ 4Ag + O2↑
2HgO (t)→ 2Hg + O2↑
6. Взаимодействие с углеродом (С) или водородом (Н2) при высокой температуре.
При восстановлении таким образом оксидов щелочных, щелочноземельных металлов и алюминия выделяется не сам металл, а его карбид.
FeO + C (t)→ Fe + CO↑
3Fe2O3 + C (t)→ 2Fe3O4 + CO↑
CaO + 3C (t)→ CaC2 + CO↑
CaO + 2h3 (t)→ Cah3 + h3O↑
7. Активные металлы восстанавливают менее активные из их оксидов при высокой температуре
CuO + Zn (t)→ ZnO + Cu
8. Кислород окисляет низшие оксиды в высшие.
Оксиды щелочных и щелочноземельных металлов переходят в пероксиды
4FeO + O2 (t)→ 2Fe2O3
2BaO + O2 (t)→ 2BaO2
2NaO + O2 (t)→ 2Na2O2
Химические свойства кислотных оксидов
1. Взаимодействие с водой
кислотный оксид + вода → кислота
SO3+ h3O → h3SO4
SiO2 + h3O ≠
У некоторых оксидов нет соответствующих кислот, в таком случае происходит реакция диспропорционирования
2NO2 + h3O → HNO3 + HNO2
3NO2 + h3O (t)→ 2HNO3 + NO↑
2ClO2 + h3O → HClO3 + HClO2
6ClO2 + 3h3O (t)→ 5HClO3 + HCl
В зависимости от количества присоединенных к P2O5 молекул воды образуются три разных кислоты — метафосфорная НРО3, пирофосфорная Н4Р2О7 или ортофосфорная Н3РО4.
P2O5 + h3O → 2HPO3
P2O5 + 2h3O → h5P2O7
P2O5 + 3h3O → 2h4PO4
Оксид хрома соответствует двум кислотам — хромовой h3CrO4 и дихромовой h3Cr2O7(III)
CrO3 + h3O → h3CrO4
2CrO3 + h3O → h3Cr2O7
2. Взаимодействие с основаниями
кислотный оксид + основание → соль + вода
Нерастворимые кислотные оксиды реагируют только при сплавлении, а растворимые — в обычных условиях.
SiO2 + 2NaOH (t)→ Na2SiO3 + h3O↑
При избытке оксида образуется кислая соль.
CO2(изб) + NaOH → NaHCO3
P2O5(изб) + 2Ca(OH)2 → 2CaHPO4 + h3O
P2O5(изб) + Ca(OH)2 + h3O → Ca(h3PO4)2
При избытке основания образуется основная соль
CO2 + 2Mg(OH)2(изб) → (MgOH)2CO3 + h3O
Оксиды, которые не имеют соответствующих кислот, вступают в реакцию диспропорционирования и образуют при этом две соли.
2NO2 + 2NaOH → NaNO3 + NaNO2 + h3O
2ClO2 + 2NaOH → NaClO3 + NaClO2 + h3O
CO2 реагирует с некоторыми амфотерными гидроксидами (Be(OH)2, Zn(OH)2, Pb(OH)2, Cu(OH)2), при этом образуется основная соль и вода.
CO2 + 2Be(OH)2 → (BeOH)2CO3↓ + h3O
CO2 + 2Cu(OH)2 → (CuOH)2CO3↓ + h3O
3. Взаимодействие с основным или амфотерным оксидом
кислотный оксид + основной/амфотерный оксид → соль
Реакции между твердыми оксидами идут при сплавлении. Амфотерные и нерастворимые в воде основные оксиды взаимодействуют только с твердыми и жидкими кислотными оксидами.
SiO2 + BaO (t)→ BaSiO3
3SO3 + Al2O3 (t)→ Al2(SO4)3
4. Взаимодействие с солью
кислотный нелетучий оксид + соль (t)→ соль + кислотный летучий оксид
Нелетучие кислотные оксиды вытесняют при сплавлении летучие кислотные оксиды из их солей.
SiO2 + CaCO3 (t)→ CaSiO3 + CO2↑
P2O5 + Na2CO3 → 2Na3PO4 + 2CO2↑
5. Кислотные оксиды не взаимодействуют с кислотами, но Р2О5 реагирует с безводными кислородсодержащими кислотами.
При этом образуется НРО3 и ангидрид соответствующей кислоты
P2O5 + 2HClO4(безводн) → Cl2O7 + 2HPO3
P2O5 + 2HNO3(безводн) → N2O5 + 2HPO3
6. Вступают в окислительно-восстановительные реакции.
1. Восстановление
При высокой температуре некоторые неметаллы могут восстанавливать оксиды.
CO2 + C (t)→ 2CO↑
SO3 + C → SO2 + CO↑
h3O + C (t)→ h3↑ + CO↑
Для восстановления неметаллов из их оксидов часто используют магнийтермию.
CO2 + 2Mg → C + 2MgO
SiO2 + 2Mg (t)→ Si + 2MgO
N2O + Mg (t)→ N2 + MgO
2. Низшие оксиды превращаются в высшие при взаимодействии с озоном (или кислородом) при высокой температуре в присутствии катализатора
NO + O3 → NO2 + O2
SO2 + O3 → SO3 + O2
2NO2 + O3 → N2O5 + O2
2CO + O2 (t)→ 2CO2
2SO2 + O2 (t, kat)→ 2SO3
P2O3 + O2 (t)→ P2O5
2NO + O2 (t)→ 2NO2
2N2O3 + O2 (t)→ 2N2O4
3. Оксиды вступают и в другие окислительно-восстановительные реакции
SO2 + NO2 → NO↑ + SO3 4NO2 + O2 + 2h3O → 4HNO3
2SO2 + 2NO → N2↑ + 2SO3 2N2O5 → 4NO2↑ + O2↑
SO2 + 2h3S → 3S↓ + 2h3O 2NO2 (t)→ 2NO↑ + O2↑
2SO2 + O2 + 2h3O → 2h3SO4 3N2O + 2Nh4 → 4N2 + 3h3O
2CO2 + 2Na2O2 → 2Na2CO3 + O2 10NO2 +8P → 5N2↑ + 4P2O5
N2O + 2Cu (t)→ N2↑ + Cu2O
2NO + 4Cu (t)→ N2↑ + 2Cu2O
N2O3 + 3Cu (t)→ N2↑ + 3CuO
2NO2 + 4Cu (t)→ N2↑ + 4CuO
N2O5 + 5Cu (t)→ N2↑ + 5CuO
Химические свойства амфотерных оксидов
1. Не взаимодействуют с водой
амфотерный оксид + вода ≠
2. Взаимодействие с кислотами
амфотерный оксид + кислота → соль + вода
Al2O3 + 3h3SO4 → Al2(SO4)3 + 3h3O
При избытке многоосновной кислоты образуется кислая соль
Al2O3 + 6h4PO4(изб) → 2Al(h3PO4)3 + 3h3O
При избытке оксида образуется основная соль
ZnO(изб) + HCl → Zn(OH)Cl
Двойные оксиды образуют две соли
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4h3O
3. Взаимодействие с кислотным оксидом
амфотерный оксид + кислотный оксид → соль
Al2O3 + 3SO3 → Al2(SO4)3
4. Взаимодействие с щелочью
амфотерный оксид + щелочь → соль + вода
При сплавлении образуется средняя соль и вода, а в растворе — комплексная соль
ZnO + 2NaOH(тв) (t)→ Na2ZnO2 + h3O↑
ZnO + 2NaOH + h3O → Na2[Zn(OH)4]
5. Взаимодействие с основным оксидом
амфотерный оксид + основной оксид (t)→ соль
ZnO + K2O (t)→ K2ZnO2
6. Вза
scienceforchildren.ru
№ | Реакция | Пример* |
1 | металл + неметалл = соль | Hg + S = HgS↓ |
2 | металл + кислород = основной оксид | 2Ca + O2 = 2CaO |
3 | металл + кислород = амфотерный оксид | Zn + O2 = ZnO |
4 | неметалл + кислород = кислотный оксид | S + O2 = SO2 |
5 | основной оксид + кислотный оксид = соль | CaO + SiO2 = CaSiO3↓ |
6 | основной оксид +амфотерный оксид = соль | Al2O3+CaO=Ca(AlO2)2 |
7 | амфотерный оксид + кислотный оксид = соль | ZnO + CO2 = ZnCO3 |
8 | основной оксид + вода = основание | BaO + H2O = Ba(OH)2 BaO + H2O = Ba2+ + 2OH– |
9 | кислотный оксид + вода = кислота | P2O5 + 3H2O = 2H3PO4 P2O5 + 3H2O = 2H+ + 2H2PO4– |
10 | кислота + температура = разложения | H2CO3 = H2O + CO2↑ |
11 | основание + кислота = соль + вода | Cu(OH)2↓ + 2HCl = CuCl2+ 2H2O Cu(OH)2↓ + 2H+ + 2Cl– = Cu2++ 2Cl–+ 2H2O Cu(OH)2↓ + 2H+ = Cu2++ 2H2O |
основание (избыток) + кислота = соль (основная) + вода | Cu(OH)2↓ + HCl = Cu(OH)Cl↓ + H2O Cu(OH)2↓ + H+ + Cl– = Cu(OH)Cl↓+ H2O | |
основание + кислота (избыток) = соль (кислая) + вода | NaOH+H2S=NaHS+H2O Na+ + OH–+H2S=Na+ + HS–+H2O OH–+H2S= HS–+H2O | |
12 | основной оксид + кислота = соль + вода | CaO + 2HCl = CaCl2 + H2O CaO + 2H+ + 2Cl– = Ca2+ + 2Cl– + H2O CaO + 2H+ = Ca2+ + H2O |
13 | кислотный оксид + основание = соль + вода | CO2+2NaOH = Na2CO3 + H2O CO2 + 2Na+ + 2OH– = 2Na+ + CO32–+H2O CO2 + 2OH– = CO32–+H2O |
14 | амфотерный оксид + основание (щелочь) = соль + вода | ZnO + 2KOH = K2ZnO2 + H2O ZnO + 2K+ + 2OH– = 2K+ + ZnO2 + H2O ZnO + 2OH– = ZnO2 + H2O |
15 | металл+кислота = соль + водород | Zn+2HCl=ZnCI2+H2↑ Zn0 + 2H+ + 2Cl– = Zn2+ + 2CI– + H20↑ Zn0 + 2H+ = Zn2+ + H20↑ |
16 | металл (активный) + вода = основание (щелочь) + водород | 2Na + 2H2O = 2NaOH + H2 2Na0 + 2H2O = 2Na+ + 2OH– + H20 |
17 | соль + основной оксид | реакция не идет |
18 | соль + амфотерный оксид = кислотный оксид (летучий) + соль | CaCO3 + Аl2О3 = CO2+ Ca(АlO2) 2 |
19 | соль + кислотный оксид = кислотный оксид (летучий) + соль | Na2CO3 + SiO2 = CO2 + Na2SiO3 |
20 | соль + кислота (сильная) = соль + кислота (слабая или летучая) | ВаCl2 + H2SO4 = ВаSO4↓ + 2HCl Ва2+ + 2Cl– + 2H+ + SO42– = ВаSO4↓ + 2H+ + 2Cl– Ва2+ + SO42– = ВаSO4↓ |
21 | соль + кислота = соль (трудно растворимая) + кислота | AgNO3 + HCl = AgCl + HNO3 Ag+ + NO3– + H++ Cl– = AgCl + H+ + NO3– Ag+ + Cl– = AgCl |
22 | соль (раствор) + соль (раствор)=соль (трудно растворимая) + соль | ВаCl2 + Na2SO4 = ВаSO4↓ + 2NaCl Ва2+ + 2Cl–+2Na++SO42–=ВаSO4↓+ 2Na+ + 2Cl– Ва2+ SO42–=ВаSO4↓ |
23 | соль + металл активный = соль+ металл неактивный | CuSO4 + Zn = ZnSO4 + Cu Cu2+ + SO42– + Zn0 = Zn2+ + SO42– + Cu0 Cu2+ + Zn0 = Zn2+ + Cu0 |
24 | соль + неметалл = соль + неметалл (или другие вещества) | Na2S + Br2 = 2NaBr + S 2Na+ + S2– + Br20 = 2Na+ + 2Br– + S0 S2– + Br20 = 2Br– + S0 |
25 | соль + температура = основной оксид + кислотный оксид | CaCO3 = CaO + CO2 |
26 | соль + температура = продукты разложения | 2КClO3 = 2КCl +3O2 2К + + 2ClO3– = 2К + + 2Cl– +3O2 2ClO3– = 2Cl– +3O2 |
27 | соль + вода = гидролиз | K2S + H2O = KHS + KOH 2K+ + S2– + H2O = 2K+ + HS– + OH– S2– + H2O = HS– + OH– |
28 | соль + вода = комплексные соли (аквакомплексы) | CuSO4 + 5H2O = [Cu (H2O)4]SO4·H2O Cu2+ + SO42– + 5H2O = [Cu(H2O)4] 2+ + SO42– +·H2O Cu2+ + 4H2O = [Cu(H2O)4]2+ |
30 | соль + щелочь (недостаток) = соль (основанная) + соль | ZnCl2+NaOH=ZnOHCl↓+NaCl Zn2+ + 2Cl–+Na+ + OH–=ZnOHCl↓+Na+ + Cl– Zn2+ + Cl–+OH–=ZnOHCl↓ |
Номер задания | Цепочки реакций | |
31 | Fe(OH)3 → Fe2O3 → Fe → FeCl3 → FeOHCl2 | |
32 | Fe → FeCl3 → FeOHCl2 → Fe2(SO4)3 → Fe(NO3)3 | |
33 | P → P2O5 → H3PO4 → Ca3(PO4)2 → Ca(H2PO4)2 | |
34 | Сu(OH)2 → CuO → Cu → CuSO4 → Cu2(OH)2 | |
35 | Al2O3 → KAlO2 → Al(OH)3 → Al2(SO4)3→ ВаSO4 | |
36 | Zn → Zn(НSO4)2 → ZnSO4 →Zn(OH)2 → Na2[Zn(OH)4] | |
37 | Zn(OH)2 → Na2ZnO2 → ZnCl2 → ZnCO3 → ZnO | |
38 | CO2 → CaCO3 → CaCl2 → CaCO3 → CO2 | |
39 | НCl → CaCl2 → Ca(OH)2 → CaCO3 → CO2 | |
10 | Si → SiO2 → Na2SiO3 → H2SiO3 → SiO2 | |
41 | AlCl3 → AlOHCl2 → Al(OH)3 → Na[Al(OH)4] → Na3[Al(OH)6] | |
42 | CaCl2 → Ca(OH)2 → CaCO3 → CO2 → CaCO3 | |
43 | Fe(OH)3 → FeOHSO4 → Fe2(SO4)3 → Fe(HSO4)2 → Fe(OH)3 | |
44 | CrCl3 → Cr(OH)3 → Na3[Cr(OH)6] → CrCl3 →AgCl | |
45 | Al → NaAlO2 → HAlO2 → K[Al(OH)4] → Al2O3 | |
46 | NaHCO3 → Na2CO3 → Na2O → Na2SO4 → NaOH | |
47 | Ва(OH)2 → ВаCO3 → ВаO → ВаCl2 → ВаSO4 | |
48 | NaOH→ Cr(OH)3 → Na3[Cr(OH)6] → Na2CrO4 → Na2Cr2O7 | |
49 | Cu → Cu(NO3)2 → Cu(OH)2 → CuCl2 → [Cu(NH3)4]Cl2 | |
50 | Fe → FeO → Fe(NO3)2 → FeSO4 → Fe(HSO4)2 | |
51 | NH3 → NO → NO2 → HNO3 → KNO3 | |
52 | CuSO4 → Cu → CuSO4→ Cu (OH)2 → CuO | |
53 | B → B2O3 → H3BO3 → HBO2 → KBO2 | |
54 | Cu → CuO → Cu (OH)2 → Na2[Cu(OH)4] → CuSO4 | |
55 | CuSO4 → CuCl2 → CuOHCl → Cu(OH)2 →Na2[Cu(OH)4] | |
56 | NH3 → NO → NO2 → HNO3 → H2SO4 | |
57 | Na2CO3 → Na2SO4 → NaOH → Cr(OH)3 → CrOHSO4 | |
58 | K2S → KHS → H2S → SO2 → H2SO3 | |
59 | CuSO4 → [Cu (H2O)4]SO4·H2O → CuCl2 → CuOHCl → Cu(OH)2 | |
60 | N2 → NH3 → NH4Cl → NH4OH → NH4NO3 |
studfiles.net
Таблица «Химические свойства неорганических веществ»
Химические свойства неорганических веществ
Кислотный оксид (кроме SiO2) + вода = кислотаКислотный оксид + основный оксид = соль
Кислотный оксид + щёлочь = соль + вода
Основные оксиды
Основный оксид + вода = щёлочь
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
Основания
Основание + кислота = соль + вода (реакция нейтрализации)
Щёлочь + кислотный оксид = соль + вода
Щёлочь + соль = новая соль + новое основание (Примечание 1)
Нерастворимое основание оксид + вода
Кислоты
Кислота + основный оксид = соль + вода
Кислота + основание = соль + вода
Кислота + металл = соль + водород (Примечание 2)
Кислота + соль = новая кислота + новая соль (Примечание 3)
Соли
Соль + щёлочь = новая соль + новое основание (Примечание 1)
Соль + кислота = новая соль + новая кислота (Примечание 3)
Соль 1 + соль 2 = соль 3 + соль 4 (Примечание 1)
Соль + металл = новая соль + новый металл (Примечание 4)
Металлы
Металл + неметалл = соль
Металл + кислота = соль + водород (Примечание 2)
Металл + соль = новый металл + новая соль (Примечание 4)
Металл + вода:
Металл активный + вода = щёлочь + водород
Металл средней активности + вода = оксид металла + водород
Металл малоактивный + вода
Вода
Вода + основный оксид = щёлочь
Вода + кислотный оксид (кроме SiO2) = кислота
Вода + металл (см. свойства Металлов)
Примечание 1
До реакции оба вещества должны быть растворимыми в воде
После реакции одно или оба вещества – нерастворимые (т.е., должен быть осадок)
Примечание 2
Металл должен находиться в ряду металлов до водорода
Нельзя брать кислоту азотную и серную концентрированную
Кислота должна быть растворимая в воде
Соль должна быть растворимая в воде
Примечание 3
Одно из двух:
Кислота, вступающая в реакцию, должна быть сильная
Кислота, полученная после реакции, должна быть слабая
ИЛИ: В результате реакции выпадает осадок
Примечание 4
Нельзя брать для реакции металлы, стоящие в ряду активности металлов до магния
Металл, вступающий в реакцию, должен быть активнее того металла, который получается
Обе соли должны быть растворимыми в воде
Примечание 5
Азотная кислота + металл (не любой) = соль + вода + какое-либо соединение азота (например, NO2)
Серная кислота (конц.) + металл (не любой) = соль + вода + какое-либо соед-е серы (например, SO2)
LiOH; H2O; Нg; BaCl2; K2SO4; HCl; Na2O; Zn; Fe(OH)3; P2O5; MgO; AgNO3; K; CuSO4; HNO3; CO2; Cl2
infourok.ru
Основания: классификация и химические свойства
Основания (гидроксиды) – сложные вещества, молекулы которых в своём составе имеют одну или несколько гидрокси-групп OH. Чаще всего основания состоят из атома металла и группы OH. Например, NaOH – гидроксид натрия, Ca(OH)2 – гидроксид кальция и др.
Существует основание – гидроксид аммония, в котором гидрокси-группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Гидроксид аммония образуется при растворении аммиака в воде (реакции присоединения воды к аммиаку):
NH3 + H2O = NH4OH (гидроксид аммония).
Валентность гирокси-группы – 1. Число гидроксильных групп в молекуле основания зависит от валентности металла и равно ей. Например, NaOH, LiOH, Al (OH)3, Ca(OH)2, Fe(OH)3 и т.д.
Все основания – твёрдые вещества, которые имеют различную окраску. Некоторые основания хорошо растворимы в воде (NaOH, KOH и др.). Однако большинство из них в воде не растворяются.
Растворимые в воде основания называются щелочами. Растворы щелочей «мыльные», скользкие на ощупь и довольно едкие. К щелочам относят гидроксиды щелочных и щелочноземельных металлов (KOH, LiOH, RbOH, NaOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 и др.). Остальные являются нерастворимыми.
Нерастворимые основания – это амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью ведут себя, как кислоты.
Разные основания отличаются разной способностью отщеплять гидрокси-группы, поэтому признаку они делятся на сильные и слабые основания.
Сильные основания | Слабые основания |
NaOH гидроксид натрия (едкий натр) KOH гидроксид калия (едкое кали) LiOH гидроксид лития Ba(OH)2 гидроксид бария Ca(OH)2 гидроксид кальция (гашеная известь) | Mg(OH)2 гидроксид магния Fe(OH)2 гидроксид железа (II) Zn(OH)2 гидроксид цинка NH4OH гидроксид аммония Fe(OH)3 гидроксид железа (III) и т.д. (большинство гидроксидов металлов) |
Сильные основания в водных растворах легко отдают свои гидрокси-группы, а слабые – нет.
Химические свойства оснований
Химические свойства оснований характеризуются отношением их к кислотам, ангидридам кислот и солям.
1. Действуют на индикаторы. Индикаторы меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. В нейтральных растворах – они имеют одну окраску, в растворах кислот – другую. При взаимодействии с основаниями они меняют свою окраску: индикатор метиловый оранжевый окрашивается в жёлтый цвет, индикатор лакмус – в синий цвет, а фенолфталеин становится цвета фуксии.
2. Взаимодействуют с кислотными оксидами с образованием соли и воды:
2NaOH + SiO2 → Na2SiO3 + H2O.
3. Вступают в реакцию с кислотами, образуя соль и воду. Реакция взаимодействия основания с кислотой называется реакцией нейтрализации, так как после её окончания среда становится нейтральной:
2KOH + H2SO4 → K2SO4 + 2H2O.
4. Реагируют с солями, образуя новые соль и основание:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4.
5. Способны при нагревании разлагаться на воду и основной оксид:
Cu(OH)2 = CuO + H2O.
Остались вопросы? Хотите знать больше об основаниях?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
