Кислотные оксиды
- Кислотный оксид + вода = кислота (исключение — SiO2)
SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4 - Кислотный оксид + щелочь = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O - Кислотный оксид + основный оксид = соль
CO2 + BaO = BaCO3
SiO
Основные оксиды
- Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH - Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O - Основный оксид + кислотный оксид = соль
MgO + CO2 = MgCO3
Na
Амфотерные оксиды
- Амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
ZnO + H2SO4 = ZnSO4 + H2O - Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2
Al2O3 + 2NaOH = 2NaAlO2 + H2O (Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]) - Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3 - Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO
Кислоты
- Кислота + основный оксид = соль + вода
2HNO3 + CuO = Cu(NO3)2 + H2O
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O - Кислота + амфотерный оксид = соль + вода
3H2SO4 + Cr2O3 = Cr2(SO4)3 + 3H2O
2HBr + ZnO = ZnBr2 + H2O - Кислота + основание = соль + вода
H2SiO3 + 2KOH = K2SiO3 + 2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O - Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH)3 = CrCl3 + 3H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O - Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO3 = CaBr2 + H2O + CO2
H2S + K2SiO3 = K2S + H2SiO - Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Zn = ZnCl2 + H2
H2SO4 (разб.) + Fe = FeSO4 + H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
Амфотерные гидроксиды
- Амфотерный гидроксид + кислота = соль + вода
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Be(OH) - Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O - Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Cr(OH)3
Щелочи
- Щелочь + кислотный оксид = соль + вода
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O
2NaOH + CO2 = Na2СO3 + H2O - Щелочь + кислота = соль + вода
3KOH + H3PO4 = K3PO4 + 3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O - Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na2ZnO2 + H2O (Правильнее: 2NaOH + ZnO + H2O = Na2[Zn(OH)4]) - Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4] - Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3KOH + FeCl3 = Fe(OH)3 + 3KCl - Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2KOH + 2Al + 6H2O = 2K[Al(OH)4] + 3H2
Соли
- Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H2CO3) - Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO3)2 + K2S = PbS + 2KNO3
СaCl2 + Na2CO3 = CaCO3 + 2NaCl - Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3 - Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Возможно, вам также будут интересны другие разделы справочника по химии:
Методы получения основных классов неорганических соединенийНазвания некоторых неорганических кислот и солей
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.

- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
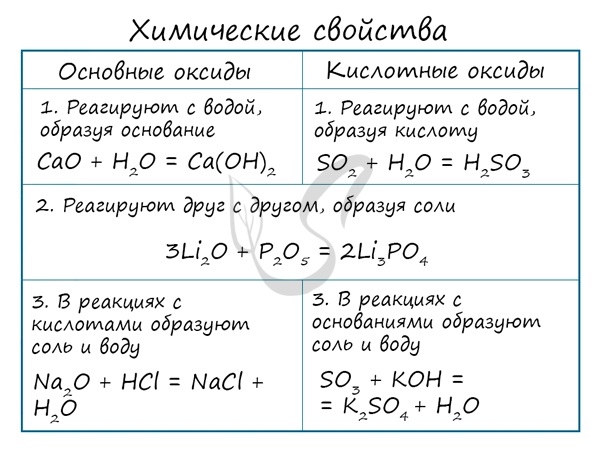
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль)
Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль)
ZnO + KOH → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой, так как продукт реакции — H2SiO3 является нерастворимой кислотой.
Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
SO3 + H2O → H2SO4 (сохраняем СО серы +6)
SO2 + H2O → H2SO3 (сохраняем СО серы +4)
Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования. К таким оксидам относят:
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
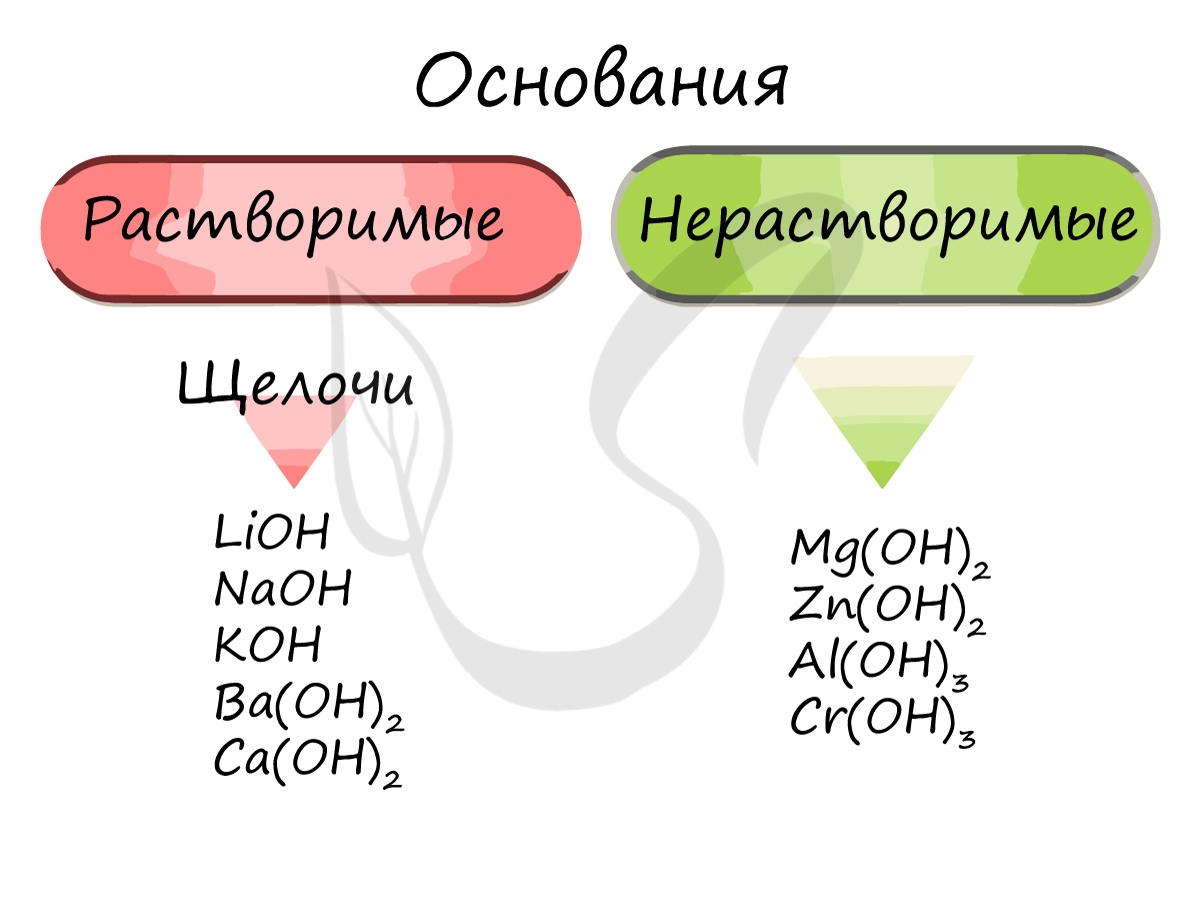
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли и воды, так и с основаниями — с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
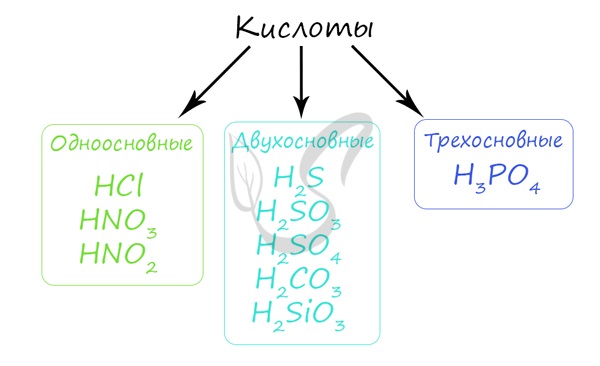
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде — виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не обманешь :)
K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
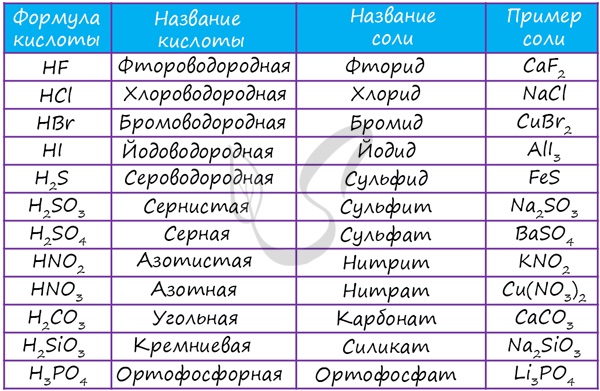
Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2)
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4] (тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)

Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода), то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
MgCl2 + LiOH → Mg(OH)2↓ + LiCl
K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

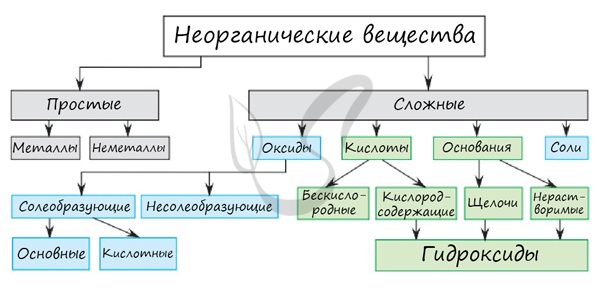
Неорганические вещества классифицируют по различным классифицирующим признакам. По химическому составу их делят на простые и сложные.
Простыми называют вещества, которые образуют атомы одного и того же химического элемента; сложными — вещества, которые образуют атомы двух и более химических элементов.
Простые вещества делят на металлы и неметаллы.
Металлами называют простые вещества, которые обладают характерными металлическими свойствами, а именно высокой электро- и теплопроводностью и металлическим блеском.
Простые вещества, которые образуют атомы элементов-неметаллов, при нормальных условиях такими свойствами не обладают.
В Периодической таблице Д. И. Менделеева неметаллы расположены в главных подгруппах справа вверху от условной диагонали, проведенной через бор и астат. В главных подгруппах слева от этой диагонали и во всех побочных подгруппах располагаются металлы.
Оксидами называют класс химических соединений, состоящий из какого-либо элемента и кислорода со степенью окисления –2.
Оксиды классифицируют так.
Несолеобразующими, или безразличными, называют оксиды, не проявляющие ни оснОвные, ни кислотные свойства, например N2O, NO, CO.
Солеобразующими называют группу кислотных, основных и амфотерных оксидов.
Кислотные оксиды образуют неметаллы и некоторые металлы в высших степенях окисления. Примеры кислотных оксидов: CO2, SiO2, N2O3, NO2, N2O5, P2O3, P2O5, SO2, SO3, Cl2O5, Cl2O7, CrO3, Mn2O7.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями с образованием солей и воды или кислых солей, а также с водой в том случае, если образующаяся в ходе такой реакции кислота растворима в воде:


Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:


Основные оксиды образуют металлы в низших степенях окисления. Наиболее известные из них: Li2O, Na2O, K2O, MgO, CaO, BaO, HgO, Ag2O.
Их характерные свойства: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:


Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:


Амфотерными называют оксиды, которые проявляют как основные, так и кислотные свойства в зависимости от другого реагента. Наиболее известные амфотерные оксиды Al2O3, Cr2O3, ZnO, BeO, PbO, SnO. Ряд оксидов, например CuО, Fe2O3, проявляет амфотерные свойства с преобладанием основных.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:


С водой амфотерные оксиды не взаимодействуют.
Основаниями называют класс химических соединений, которые состоят из катиона металла или иона аммония и одной или нескольких гидроксильных групп, способных к замещению на анионы.
Число гидроксильных групп определяет кислотность основания.
Щелочами называют растворимые в воде основания.
Сильные основания: гидроксиды щелочных и щелочноземельных металлов LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2. Слабые основания: все нерастворимые в воде гидроксиды металлов и гидрат аммиака.
Все основания легко реагируют с кислотами (реакция нейтрализации) и кислотными оксидами с образованием солей и воды:


Основания могут вступать в реакцию с кислыми солями:


Щелочи при сплавлении с амфотерными оксидами дают соль и воду:


Щелочи могут вступать в реакции обмена с солями, если в результате этой реакции образуется осадок, например:


Нерастворимые в воде основания, а также гидроксид лития при нагревании разлагаются на оксид и воду:


Кислотами называют класс химических соединений, которые содержат в своем составе один или несколько катионов водорода, способных замещаться на атомы металлов, и анионов кислотных остатков.
Неорганическими кислотами называют вещества, молекулы которых при электролитической диссоциации в водной среде отщепляют протоны, в результате чего в растворе образуются гидроксоний-катионы Н3О+ и анионы кислотных остатков А–:


Исключение составляет борная кислота В(ОН)3, которая акцептирует гидроксид-ионы ОН–, в результате чего в водном растворе создается избыток гидроксоний-катионов:


Именно поэтому формулу H3BO3 и соответственно название борная кислота применять не рекомендуется, поскольку все три атома водорода молекулы В(ОН)3 не являются кислотными, т. е. не подвергаются кислотной диссоциации по Аррениусу или кислотному протолизу по Бренстеду.
Основностью кислоты называют число способных замещаться на металл атомов водорода в ее молекуле. По основности кислоты делят на одно-, двух- и трехосновные, например HBr, H2S и H3PO4 соответственно.
В зависимости от элементного состава кислоты делят на бескислородные и кислородные, например HBr и H2SO3.
Кислотный остаток — это структурный элемент молекулы кислоты, который выступает как единое целое в ходе химических реакций.
Все кислоты вступают в реакцию с основаниями с образованием солей и воды (реакция нейтрализации), с основными и амфотерными оксидами с образованием солей и воды, например:


Водные растворы сильных кислот вступают в реакцию с металлами, которые стоят в ряду напряжений металлов левее водорода, с образованием соли и выделением водорода:


Исключением является азотная кислота в любой концентрации и концентрированная серная кислота. В этих случаях водород не выделяется, а происходит восстановление атомов азота и серы соответственно.
Сильные кислоты вытесняют более слабые кислоты из их солей. При этом образуется новая кислота и новая соль:


Сильные кислоты: HI, HBr, HCl, HClO4, H2SO4, HNO3, H2CrO4, H2Cr2O7, HMnO4.
Кислоты средней силы: H2SO3, H3PO4, HF, HNO2.
Слабые кислоты: CH3COOH, H2CO3, H2S.
Кислородсодержащие кислоты и основания объединяют в общий класс гидроксидов.
Амфотерными называют гидроксиды, способные реагировать как с кислотами, так и с основаниями. Амфотерные гидроксиды: Al(OH)3, Cr(OH)3, Zn(OH)2, Pb(OH)2, Be(OH)2, Sn(OH)2 Некоторые гидроксиды (Cu(OH)2, Fe(OH)3) проявляют амфотерные свойства с преобладанием основных. Проиллюстрируем химические свойства амфотерных гидроксидов на примере реакций гидроксида цинка.
Химические свойства гидроксида:


Солями называют класс химических соединений, которые представляют собой продукты взаимодействия кислот с основаниями.
По составу соли классифицируют на средние, кислые и основные.
Средними называют соли, которые состоят только из катиона металла или иона аммония и аниона кислотного остатка, например: CsBr, MgSO4.
Кислыми называют соли, которые наряду с катионом металла содержат катионы водорода, способные замещаться на другие катионы в ходе обменных реакций, например: LiHCO3, CaHPO4.
Основными называют соли, которые наряду с анионом кислотного остатка содержат одну или несколько гидроксильных групп, способных замещаться на анионы в ходе реакций обмена, например: Al(OH)Br2, Cu(OH)I.
Комплексными называют соли, которые содержат в своем составе комплексные катионы и/или анионы, например: K4[Fe(CN)6], [Ag(NH3)2]Cl.
Двойными называют соли, формально представляющие собой продукты взаимодействия двух простых солей, например: KAl(SO4)2.
Смешанными называют соли, являющиеся производными нескольких кислот и/или оснований, например: BaClBr.
Соли могут реагировать с кислотами с образованием кислых солей; более сильные кислоты могут вытеснять более слабые из их солей:


Соли взаимодействуют со щелочами:


Растворимые в воде соли могут вступать друг с другом в реакции обмена, если один из продуктов уходит из сферы реакции в виде осадка, например:


Растворы или расплавы солей вступают во взаимодействие с металлами, стоящими левее, чем металл, входящий в состав соли, в ряду стандартных электродных потенциалов:


Кислые соли вступают в реакции со щелочами с образованием средних солей и воды:


Некоторые кислые соли, например угольной кислоты, разлагаются под действием более сильных кислот:


ОснОвные соли вступают в реакции с кислотами:


Комплексные соли реагируют с сильными кислотами, продукты реакции зависят от соотношения между реагентами, например:


При нагревании комплексные соли теряют воду:


Классификацию неорганических веществ можно представить следующей самой общей схемой:


Химические свойства основных оксидов | CHEMEGE.RU
Подробно про оксиды, их классификацию и способы получения можно прочитать здесь.
1. Взаимодействие с водой. С водой способны реагировать только основные оксиды, которым соответствуют растворимые гидроксиды (щелочи). Щелочи образуют щелочные металлы (литий, натрий, калий, рубидий и цезий) и щелочно-земельные (кальций, стронций, барий). Оксиды остальных металлов с водой химически не реагируют. Оксид магния реагирует с водой при кипячении.
CaO + H2O → Ca(OH)2
CuO + H2O ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
2. Взаимодействие с кислотными оксидами и кислотами. При взаимодействии основным оксидов с кислотами образуется соль этой кислоты и вода. При взаимодействии основного оксида и кислотного образуется соль:
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
При взаимодействии основных оксидов с кислотами и их оксидами работает правило:
Хотя бы одному из реагентов должен соответствовать сильный гидроксид (щелочь или сильная кислота).
Иными словами, основные оксиды, которым соответствуют щелочи, реагируют со всеми кислотными оксидами и их кислотами. Основные оксиды, которым соответствуют нерастворимые гидроксиды, реагируют только с сильными кислотами и их оксидами (N2O5, NO2, SO3 и т.д.).
| Основные оксиды, которым соответствуют щелочи | Основные оксиды, которым соответствуют нерастворимые основания |
| Реагируют со всеми кислотами и их оксидами | Реагируют только с сильными кислотами и их оксидами |
| Na2O + SO2 → Na2SO3 | CuO + N2O5 → Cu(NO3)2 |
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи. При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
K2O + Al2O3 → 2KAlO2
CuO + Al2O3 ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
(чтобы определить кислотный остаток, к формуле амфотерного или кислотного оксида добавляем молекулу воды: Al2O3 + H2O = H2Al2O4 и делим получившиеся индексы пополам, если степень окисления элемента нечетная: HAlO2. Получается алюминат-ион AlO2—. Заряд иона легко определить по числу присоединенных атомов водорода — если атом водорода 1, то заряд аниона будет -1, если 2 водорода, то -2 и т.д.).
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие оксидов металлов с восстановителями.
При оценке окислительно-восстановительной активности металлов и их ионов можно использовать электрохимический ряд напряжений металлов:

Восстановительные свойства (способность отдавать электроны) у простых веществ-металлов здесь увеличиваются справа налево, окислительные свойства ионов металлов — увеличиваются наоборот, слева направо. При этом некоторые ионы металлов в промежуточных степенях окисления могут проявлять также восстановительные свойства (например ион Fe2+ можно окислить до иона Fe3+).
Более подробно про окислительно-восстановительные реакции можно прочитать здесь.
Таким образом, ионы некоторых металлов — окислители (чем правее в ряду напряжений, тем сильнее). При взаимодействии с восстановителями металлы переходят в степень окисления 0.
4.1. Восстановление углем или угарным газом.
Углерод (уголь) восстанавливает из оксидов до простых веществ только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании.
FeO + C = Fe + CO

Активные металлы, расположенные в ряду активности левее алюминия, активно взаимодействуют с углеродом, поэтому при взаимодействии их оксидов с углеродом образуются карбиды и угарный газ:
CaO + 3C = CaC2 + CO
Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду:
Fe2O3 + CO = Al2O3 + CO2
CuO + CO = Cu + CO2

4.2. Восстановление водородом.
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.
CuO + H2 = Cu + H2O

4.3. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла)
При этом более активные металлы вытесняют менее активные. То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании.
Например, оксид цинка взаимодействует с алюминием:
3ZnO + 2Al = Al2O3 + 3Zn
но не взаимодействует с медью:
ZnO + Cu ≠
Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Например, цезий взрывается на воздухе.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например: алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO

Железо можно вытеснить из оксида с помощью алюминия:
2Fe2O3 + 4Al → 4Fe + 2Al2O3
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
4.4. Восстановление аммиаком.
Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре.
Например, аммиак восстанавливает оксид меди (II):
3CuO + 2NH3 = 3Cu + 3H2O + N2
5. Взаимодействие оксидов металлов с окислителями.
Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe2+, Cr2+, Mn2+ и др.) могут выступать в качестве восстановителей.
Например, оксид железа (II) можно окислить кислородом до оксида железа (III):
4FeO + O2 = 2Fe2O3
Все химические элементы разделяют на металлы и неметаллы в зависимости от строения и свойств их атомов. Также на металлы и неметаллы классифицируют образуемые элементами простые вещества, исходя из их физических и химических свойств.
В Периодической системе химических элементов Д.И. Менделеева неметаллы расположены по диагонали: бор – астат и над ней в главных подгруппах.
Для атомов металлов характерны сравнительно большие радиусы и небольшое число электронов на внешнем уровне от 1 до 3 (исключение: германий, олово свинец – 4; сурьма и висмут — 5; полоний — 6 электронов).
Атомам неметаллов, наоборот, свойственны небольшие радиусы атомов и число электронов на внешнем уровне от 4 до 8 (исключение бор, у него таких электронов – три).
Отсюда стремление атомов металлов к отдаче внешних электронов, т.е. восстановительные свойства, а для атомов неметаллов – стремление к приему недостающих до устойчивого восьмиэлектронного уровня электронов, т.е. окислительные свойства.
В металлах – металлическая связь и металлическая кристаллическая решетка. В узлах решетки находятся положительно заряженные ионы металлов, связанные посредством обобществленных внешних электронов, принадлежащих всему кристаллу.
Это обуславливает все важнейшие физические свойства металлов: металлический блеск, электро- и теплопроводность, пластичность (способность изменять форму под внешним воздействием) и некоторые другие, характерные для этого класса простых веществ.
Металлы I группы главной подгруппы называют щелочными металлами.
Металлы II группы: кальций, стронций, барий – щелочноземельными.
В химических реакциях металлы проявляют только восстановительные свойства, т.е. их атомы отдают электроны, образуя в результате положительные ионы.
1. Взаимодействуют с неметаллами:
а) кислородом (с образованием оксидов)
Щелочные и щелочноземельные металлы окисляются легко при обычных условиях, поэтому их хранят под слоем вазелинового масла или керосина.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO
Обратите внимание: при взаимодействии натрия – образуется пероксид, калия — надпероксид
2Na + O2 = Na2O2, К + О2 = КО2
а оксиды получают прокаливанием пероксида с соответствующими металлом:
2Na + Na2O2 = 2Na2O
Железо, цинк, медь и другие менее активные металлы медленно окисляются на воздухе и активно при нагревании.
3Fe + 2O2 = Fe3O4 (смесь двух оксидов: FeO и Fe2O3)
2Zn + O2 = 2ZnO
2Cu + O2 = 2CuO
Золото и платиновые металлы не окисляются кислородом воздуха ни при каких условиях.
б) водородом (с образованием гидридов)
2Na + H2 = 2NaH
Ca + H2 = CaH2
в) хлором (с образованием хлоридов)
2K + Cl2 = 2KCl
Mg + Cl2 = MgCl2
2Al + 3Cl2 =2AlCl3
Обратите внимание: при взаимодействии железа образуется хлорид железа (III):
2Fe + 3Cl2 = 2FeCl3
г) серой (с образованием сульфидов)
2Na + S = Na2S
Hg + S = HgS
2Al + 3S = Al2S3
Обратите внимание: при взаимодействии железа образуется сульфид железа (II):
Fe + S = FeS
д) азотом (с образованием нитридов)
6K + N2 = 2K3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2. Взаимодействуют со сложными веществами:
Необходимо помнить, что по восстановительной способности металлы расположены в ряд, который называют электрохимическим рядом напряжений или активности металлов (вытеснительный ряд Бекетова Н.Н.):
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au, Pt
а) водой
Металлы, расположенные в ряду до магния, при обычных условиях вытесняют водород из воды, образуя растворимые основания – щелочи.
2Na + 2H2O = 2NaOH + H2↑
Ba + H2O = Ba(OH) 2 + H2↑
Магний взаимодействует с водой при кипячении.
Mg + 2H2O = Mg(OH) 2 + H2↑
Алюминий при удалении оксидной пленки бурно реагирует с водой.
2Al + 6H2O = 2Al(OH) 3 + 3H2↑
Остальные металлы, стоящие в ряду до водорода, при определенных условиях тоже могут вступать в реакцию с водой с выделением водорода и образованием оксидов.
3Fe + 4H2O = Fe3O4 + 4H2↑
б) растворами кислот
(Кроме концентрированной серной кислоты и азотной кислоты любой концентрации. См. раздел «Окислительно-восстановительные реакции».)
Обратите внимание: не используют для проведения реакций нерастворимую кремниевую кислоту
Металлы, стоящие в ряду до магния и активно реагирующие с водой, не используют для проведения таких реакций.
Металлы, стоящие в ряду от магния до водорода, вытесняют водород из кислот.
Mg + 2HCl = MgCl2 + H2↑
Обратите внимание: образуются соли двухвалентного железа.
Fe + H2SO4(разб.) = FeSO4 + H2↑
Образование нерастворимой соли препятствует протеканию реакции. Например, свинец практически не реагирует с раствором серной кислоты из-за образования на поверхности нерастворимого сульфата свинца.
Металлы, стоящие в ряду после водорода, НЕ вытесняют водород.
в) растворами солей
Металлы, стоящие в ряду до магния и активно реагирующие с водой, не используют для проведения таких реакций.
Для остальных металлов выполняется правило:
Каждый металл вытесняет из растворов солей другие металлы, расположенные в ряду правее него, и сам может быть вытеснен металлами, расположенными левее него.
Cu + HgCl2 = Hg + CuCl2
Fe + CuSO4 = FeSO4 + Cu
Как и в случае с растворами кислот, образование нерастворимой соли препятствует протеканию реакции.
г) растворами щелочей
Взаимодействуют металлы, гидроксиды которых амфотерны.
Zn + 2NaOH + 2H2O = Na2 [Zn(OH) 4] + H2↑
2Al + 2KOH + 6H2O = 2K[Al(OH) 4] + 3H2↑
д) с органическими веществами
Щелочные металлы со спиртами и фенолом.
2C2H5OH + 2Na = 2C2H5ONa + H2↑
2C6H5OH + 2Na = 2C6H5ONa + H2↑
Металлы участвуют в реакциях с галогеналканами, которые используют для получения низших циклоалканов и для синтезов, в ходе которых происходит усложнение углеродного скелета молекулы (реакция А.Вюрца):
CH2Cl-CH2-CH2Cl + Zn = C3H6(циклопропан) + ZnCl2
2CH2Cl + 2Na = C2H6(этан) + 2NaCl
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. При этом образуются одинарные (в молекулах H2, F2, Cl2, Br2, I2), двойные (в молекулах О2), тройные (в молекулах N2) ковалентные связи.
1. молекулярное
При обычных условиях большинство таких веществ представляют собой газы (Н2, N2, O2, O3, F2, Cl2) или твердые вещества (I2, P4, S8) и лишь единственный бром (Br2) является жидкостью. Все эти вещества молекулярного строения, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
2. атомное
Эти вещества образованы кристаллами, в узлах которых находятся атомы: (Bn, Сn, Sin, Gen, Sen, Ten). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением
ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма
мала.
Многие элементы – неметаллы образуют несколько простых веществ – аллотропных модификаций. Аллотропия может быть связана с разным составом молекул: кислород О2 и озон О3 и с разным строением кристаллов: аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен. Элементы – неметаллы, имеющие аллотропные модификации: углерод, кремний, фосфор, мышьяк, кислород, сера, селен, теллур.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. Эту способность характеризует значение электроотрицательности. В ряду неметаллов
At, B, Te, H, As, I, Si, P, Se, C, S, Br, Cl, N, O, F
электроотрицательность возрастает и усиливаются окислительные свойства.
Отсюда следует, что для простых веществ – неметаллов будут характерны как окислительные, так и восстановительные свойства, за исключением фтора – самого сильного окислителя.
1. Окислительные свойства
а) в реакциях с металлами (металлы всегда восстановители)
2Na + S = Na2S (сульфид натрия)
3Mg + N2 = Mg3N2 (нитрид магния)
б) в реакциях с неметаллами, расположенными левее данного, то есть с меньшим значением электроотрицательности. Например, при взаимодействии фосфора и серы окислителем будет сера, так как фосфор имеет меньшее значение электроотрицательности:
2P + 5S = P2S5 (сульфид фосфора V)
Большинство неметаллов будут окислителями в реакциях с водородом:
H2 + S = H2S
H2 + Cl2 = 2HCl
3H2 + N2 = 2NH3
в) в реакциях с некоторыми сложными веществами
Окислитель – кислород, реакции горения
CH4 + 2O2 = CO2 + 2H2O
2SO2 + O2 = 2SO3
Окислитель – хлор
2FeCl2 + Cl2 = 2FeCl3
2KI + Cl2 = 2KCl + I2
CH4 + Cl2 = CH3Cl + HCl
Ch2=CH2 + Br2 = CH2Br-CH2Br
2. Восстановительные свойства
а) в реакциях с фтором
S + 3F2 = SF6
H2 + F2 = 2HF
Si + 2F2 = SiF4
б) в реакциях с кислородом (кроме фтора)
S + O2 = SO2
N2 + O2 = 2NO
4P + 5O2 = 2P2O5
C + O2 = CO2
в) в реакциях со сложными веществами – окислителями
H2 + CuO = Cu + H2O
6P + 5KClO3 = 5KCl + 3P2O5
C + 4HNO3 = CO2 + 4NO2 + 2H2O
H2C=O + H2 = CH3OH
3. Реакции диспропорционирования: один и тот же неметалл является и окислителем и восстановителем
Cl2 + H2O = HCl + HClO
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Основания. Химические свойства и получение
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Основания – сложные вещества, которые состоят из катиона металла Ме+ (или металлоподобного катиона, например, иона аммония NH4+) и гидроксид-аниона ОН—.
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания. Также есть неустойчивые основания, которые самопроизвольно разлагаются.

1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например, оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий), кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например, калий реагирует с водой очень бурно:
2K0 + 2H2+O → 2K+OH + H20


3. Электролиз растворов некоторых солей щелочных металлов. Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
либо
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl

1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например, гидроксид меди (II) взаимодействует с сильной соляной кислотой:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
Cu(OH)2 + CO2 ≠
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например, гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
2Fe(OH)3 = Fe2O3 + 3H2O
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например, гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4Fe+2(OH)2 + O20 + 2H2O → 4Fe+3(O-2H)3
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O


2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли, а в растворе – комплексные соли.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например, при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
NaOH + Al(OH)3 = NaAlO2 + 2H2O
А в растворе образуется комплексная соль:
NaOH + Al(OH)3 = Na[Al(OH)4]
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (как правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.

3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
либо:
щёлочь + кислотный оксид(избыток) = кислая соль
Например, при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
2NaOH + CO2 = Na2CO3 + H2O
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе, при условии, что в продуктах образуется газ или осадок. Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Например, гидроксид натрия взаимодействует с сульфатом меди в растворе:
Cu2+SO42- + 2Na+OH— = Cu2+(OH)2—↓ + Na2+SO42-
Также щёлочи взаимодействуют с растворами солей аммония.
Например, гидроксид калия взаимодействует с раствором нитрата аммония:
NH4+NO3— + K+OH— = K+NO3— + NH3↑ + H2O
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид, взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла.
Например, избыток сульфата цинка реагирует в растворе с гидроксидом калия:
ZnSO4 + 2KOH = Zn(OH)2↓ + K2SO4
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей. Таким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
ZnSO4 + 4KOH = K2[Zn(OH)4] + K2SO4
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль

5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например, гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
KHSO3 + KOH = K2SO3 + H2O
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20

7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH + Si0 + H2+O= Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.

8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Химические свойства гидроксида металла во многом зависят от того, к какой группе он принадлежит — к щелочам или к нерастворимым основаниям.
Общие химические свойства щелочей
1. Кристаллы щелочей при растворении в воде полностью диссоциируют, то есть распадаются на положительно заряженные ионы металла и отрицательно заряженные гидроксид-ионы.
A) Например, при диссоциации гидроксида натрия образуются положительно заряженные ионы натрия и отрицательно заряженные гидроксид-ионы:
NaOH→Na++OH−.
Б) Процесс диссоциации гидроксида кальция отображается следующим уравнением:
Ca(OH)2→Ca2++2OH−.
2. Растворы щелочей изменяют окраску индикаторов.
Фактически с индикатором взаимодействуют гидроксид-ионы, содержащиеся в растворе любой щёлочи. При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски вещества.
Изменение окраски индикаторов в растворах щелочей
Индикатор | Изменение окраски индикатора |
| Лакмус | Фиолетовый лакмус становится синим  |
| Фенолфталеин | Беcцветный фенолфталеин становится малиновым  |
Универсальный индикатор | Универсальный индикатор становится синим  |
Видеофрагмент:
Действие щелочей на индикаторы |
3. Щёлочи взаимодействуют с кислотами, образуя соль и воду.
Реакции обмена между щелочами и кислотами называют реакциями нейтрализации.
А) Например, при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода: NaOH+HCl→NaCl+h3O.
Видеофрагмент:
Взаимодействие гидроксида натрия с соляной кислотой |
Б) Если нейтрализовать гидроксид кальция азотной кислотой, образуются нитрат кальция и вода:
Ca(OH)2+2HNO3→Ca(NO3)2+2h3O.
4. Щёлочи взаимодействуют с кислотными оксидами, образуя соль и воду.
А) Например, при взаимодействии гидроксида кальция с оксидом углерода(\(IV\)) т. е. углекислым газом, образуются карбонат кальция и вода:
Ca(OH)2+CO2→CaCO3↓+h3O.
Обрати внимание!
При помощи этой химической реакции можно доказать присутствие оксида углерода(\(IV\)): при пропускании углекислого газа через известковую воду (насыщенный раствор гидроксида кальция) раствор мутнеет, поскольку выпадает осадок белого цвета — образуется нерастворимый карбонат кальция.
Б) При взаимодействии гидроксида натрия с оксидом фосфора(\(V\)) образуются фосфат натрия и вода:
6NaOH+P2O5→2Na3PO4+3h3O.
5. Щёлочи могут взаимодействовать с растворимыми в воде солями.
Обрати внимание!
Реакция обмена между основанием и солью возможна в том случае, если оба исходных вещества растворимы, а в результате образуется хотя бы одно нерастворимое вещество (выпадает осадок).
А) Например, при взаимодействии гидроксида натрия с сульфатом меди(\(II\)) образуются сульфат натрия и гидроксид меди(\(II\)):
2NaOH+CuSO4→Na2SO4+Cu(OH)2↓.
Б) При взаимодействии гидроксида кальция с карбонатом натрия образуются карбонат кальция и гидроксид натрия:
Ca(OH)2+Na2CO3→CaCO3↓+2NaOH.
6. Малорастворимые щёлочи при нагревании разлагаются на оксид металла и воду.
Например, если нагреть гидроксид кальция, образуются оксид кальция и водяной пар:
Ca(OH)2⟶t°CaO+h3O↑.
Общие химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с кислотами, образуя соль и воду.
А) Например, при взаимодействии гидроксида меди(\(II\)) с серной кислотой образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+h3SO4→CuSO4+2h3O.
Б) При взаимодействии гидроксида железа(\(III\)) с соляной (хлороводородной) кислотой образуются хлорид железа(\(III\)) и вода:
Fe(OH)3+3HCl→FeCl3+3h3O.
Видеофрагмент:
Взаимодействие гидроксида железа(\(III\)) с соляной кислотой |
2. Некоторые нерастворимые основания могут взаимодействовать с некоторыми кислотными оксидами, образуя соль и воду.
Например, при взаимодействии гидроксида меди(\(II\)) с оксидом серы(\(VI\)) образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+SO3⟶t°CuSO4+h3O.
3. Нерастворимые основания при нагревании разлагаются на оксид металла и воду.
А) Например, при нагревании гидроксида меди(\(II\)) образуются оксид меди(\(II\)) и вода:
Cu(OH)2⟶t°CuO+h3O.
Видеофрагмент:
Разложение гидроксида меди(\(II\)) |
Б) Гидроксид железа(\(III\)) при нагревании разлагается на оксид железа(\(III\)) и воду:
2Fe(OH)3⟶t°Fe2O3+3h3O.
Основные химические вещества
В Основная химическая промышленность — онлайн , есть 76 единиц, которые кратко описывают ключевые аспекты химической промышленности. Они разработаны таким образом, чтобы вы могли «окунуться» в них, чтобы получить необходимую информацию.
Хотя эти единицы являются автономными, вы обнаружите, что на этом веб-сайте есть перекрестные ссылки на материалы в других единицах, которые легко получить по указанным гиперссылкам. Существует также средство, которое позволяет вам искать весь сайт.Эти два подхода помогут вам следить за смежными темами и изучать их более широко.
Существует обзор химической промышленности, которая рассматривает отрасль в международном контексте. Остальные 75 единиц представлены в пяти тематических группах:
- Производственные процессы
- Материалы и приложения
- Основные химические вещества
- Полимеры
- Металлы
Основные химикаты, производимые в больших количествах, в основном продаются в химической и других отраслях промышленности, прежде чем стать продуктами для широкого потребителя.В этой группе единиц каждое химическое вещество описывается одинаково, в трех основных разделах, которые мгновенно ведут вас к соответствующей информации:
- Использует
- Годовой объем производства
- Производство
Существуют единицы по основным органическим и неорганическим соединениям.
Органические соединения представляют собой либо строительные блоки, такие как этен, пропен, бутадиен и бензол, и то, как они используются для изготовления пластмасс и фармацевтических препаратов, либо соединения, изготовленные из этих строительных блоков, такие как этан-1,2-диол, этановая кислота и метанал. полезны сами по себе или используются для приготовления других полезных соединений.
Неорганические химические вещества, включенные в этот веб-сайт, представляют собой такие соединения, как карбонат кальция, хлор, хлористый водород, азотная кислота, гидроксид натрия, карбонат натрия и серная кислота, которые используются для получения других соединений, включая пластмассы, удобрения, мыло и поверхностно-активные вещества, и строительные материалы.
,FUCHSIN BASIC | 632-99-5
FUCHSIN BASIC Химические свойства, применение, Производство
Химические свойства
Зеленый кристаллический порошокИспользует
В качестве красителя или в производстве других красителей.Определение
ХЭБИ: гидрохлорид, который является моногидрохлоридом 4 — [(4-аминофенил) (4-иминоциклогекса-2,5-диен-1-илиден) метил] -2-метиланилина.Один из основных компонентов основного фуксина, вместе с парарозанилином, пурпурным II и новым фуксином.Общее описание
Темно-зеленый порошок. Краситель, полученный из трифенилметана.Реакции воздуха и воды
Слабо растворим в воде.Реактивность профиля
FUCHSIN BASIC нейтрализует кислоты в экзотермических реакциях с образованием солей и воды. Может быть несовместимо с изоцианатами, галогенированными органическими веществами, пероксидами, фенолами (кислотными), эпоксидами, ангидридами и галогенидами кислот.Может генерировать водород, горючий газ, в сочетании с сильными восстановителями, такими как гидриды. Легко превращается в бесцветные лейко-основы.Пожарная опасность
Данные о температуре вспышки для FUCHSIN BASIC недоступны, но FUCHSIN BASIC, вероятно, является горючим.Клиническое использование
Основной фуксин представляет собой смесь хлоридов розанилина и п-розанилина. Он существует в виде зеленого кристаллического порошка с аметаллическим внешним видом. Это соединение растворимо в воде и спирте, но нерастворимо в эфире.Основной фуксин является компонентом раствора карбол-фуксин (краска Кастеллани), который используется местно при лечении грибковых инфекций, особенно червя и стопы спортсмена.Методы очистки
Очищайте краситель, растворяя его в EtOH, фильтруя и добавляя воду. Фильтруют или центрифугируют, промывают осадок Et2O и сушат на воздухе. Его также перекристаллизовывают из воды и сушат в вакууме при 40oC. Кристаллы имеют металлический зеленый блеск. Максимальное ультрафиолетовое излучение в EtOH составляет 543 нм (93 000).Его растворимость в воде составляет 0,26%. Карминно-красный цвет получается в EtOH. Это параРозанилин с метильной группой. [Scalan J Am Chem Soc 57 887 1937.]FUCHSIN BASIC Подготовка продуктов и сырья
Сырье
Продукты для приготовления
,2.11: металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Металлы
- Физические свойства металлов
- Химические свойства металлов
- Неметаллы
- Физические свойства неметаллов:
- Химические свойства неметаллов
- Металлоиды
- Физические свойства металлоидов
- Химические свойства металлов
- Химические свойства металлов
- Тенденции в металлическом и неметаллическом характере
- Участники
навыков для развития
- Чтобы понять основные свойства, отделяющие металлы от неметаллов и металлоидов
Элемент — это самая простая форма материи, которая не может быть разделена на более простые вещества или построена из более простых веществ любым обычным химическим или физическим методом.Нам известно 110 элементов, из которых 92 встречаются в природе, а остальные были подготовлены искусственно. Элементы далее подразделяются на металлы, неметаллы и металлоиды.
Металлические элементы | Неметаллические элементы |
|---|---|
Отличительный блеск (блеск) | Не блестящие, различные цвета |
Податливая и пластичная (гибкая) как твердое вещество | хрупкий, твердый или мягкий |
Проводить тепло и электричество | плохие проводники |
Оксиды металлов основные, ионные | Кислоты неметаллические кислотные, соединения |
катионов в водном растворе | Анионы, оксианионы в водном растворе |
Металлы
Все элементы, кроме водорода, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами.Таким образом, металлы являются электроположительными элементами. Они характеризуются ярким блеском, твердостью, способностью резонировать звук и являются отличными проводниками тепла и электричества. В нормальных условиях металлы являются твердыми веществами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, ковкие, пластичные, хорошие проводники тепла и электричества. Другие свойства включают в себя:
- Состояние : Металлы — это твердые вещества при комнатной температуре, за исключением ртути, которая является жидкой при комнатной температуре (галлий является жидким в жаркие дни).
- Блеск : Металлы имеют качество отражения света от своей поверхности и могут быть отполированы, например, золото, серебро и медь.
- Ковкость: Металлы обладают способностью противостоять ударам и могут быть изготовлены из тонких листов, известных как фольга (кусок золота в виде кусочка сахара можно растолочь в тонкий лист, который будет покрывать футбольное поле).
- Пластичность: Металлы можно вытягивать в провода. 100 г серебра можно вытянуть в тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и могут быть разрезаны ножом.
- Валентность: Металлы имеют от 1 до 3 электронов во внешней оболочке своих атомов.
- Проводимость : Металлы — хорошие проводники, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые.Иридий и осмий имеют самые высокие плотности, тогда как литий имеет самую низкую плотность.
- Точки плавления и кипения : Металлы имеют высокую температуру плавления и кипения. Вольфрам имеет самую высокую температуру плавления, где серебро имеет низкую температуру кипения. Натрий и калий имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основные или амфотерные оксиды с кислородом. Другие химические свойства включают в себя:
- Электроположительный характер : Металлы, как правило, имеют низкую энергию ионизации, и обычно теряют электроны (т.е.- \]
- Щелочные металлы всегда 1 + (потеря электрона в с подоболочек)
- Щелочноземельные металлы всегда 2 + (потеря обоих электронов в с подоболочек)
- Ионы переходных металлов не следуют очевидной схеме, обычно встречается 2 + , а также наблюдаются 1 + и 3 +
- Соединения металлов с неметаллами, как правило, ионных в природе
- Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием Гидроксиды металлов :
Оксид металла + вода -> гидроксид металла
Na 2 O ( с ) + H 2 O ( l ) -> 2NaOH ( aq )
CaO ( с ) + H 2 O ( l ) -> Ca (OH) 2 ( aq )
- Оксиды металлов проявляют свою химическую природу , основную , реагируя с кислотами с образованием солей и воды:
Оксид металла + кислота -> соль + вода
MgO ( с ) + HCl ( водн. ) -> MgCl 2 ( водн. ) + H 2 O ( л )
NiO ( s ) + H 2 SO 4 ( aq ) -> NiSO 4 ( aq ) + H 2 O ( l )
Пример
Какая химическая формула для оксида алюминия?
Решение
Al имеет заряд 3+, ион оксида O 2- , таким образом Al 2 O 3
Пример
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов характерно твердые при комнатной температуре
Пример
Напишите сбалансированное химическое уравнение для реакции оксида алюминия с азотной кислотой:
Решение
Оксид металла + кислота -> соль + вода
Al 2 O 3 ( s ) + 6HNO 3 ( aq ) -> 2Al (NO 3 ) 3 ( aq ) + 3H 2 O () )
Неметаллы
Элементы, которые имеют тенденцию приобретать электроны, чтобы сформировать анионы во время химических реакций, называют неметаллами.Это электроотрицательные элементы. Это не блестящие, хрупкие и плохие проводники тепла и электричества (кроме графита). Неметаллы могут быть газообразными, жидкими или твердыми.
Физические свойства неметаллов:
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газы (кислород) и твердые вещества (углерод).
- Неметаллический и пластичный : Неметаллы очень хрупкие и не могут быть свернуты в проволоку или растолкнуты в листы.
- Проводимость : Они плохие проводники тепла и электричества.
- Блеск: Они не имеют металлического блеска и не отражают свет
- Проводимость : плохие проводники тепла и электричества
- Точки плавления и кипения : Точки плавления неметаллов , как правило, на ниже металлов
- Семь неметаллов существуют в стандартных условиях как двухатомных молекул :
- H 2 ( г )
- N 2 ( г )
- O 2 ( г )
- F 2 ( г )
- Cl 2 ( г )
- Br 2 ( l )
- I 2 ( l ) (летучая жидкость — легко испаряется)
Химические свойства неметаллов
- Неметаллы имеют тенденцию приобретать или делиться электронами с другими атомами.Они электроотрицательны по своему характеру.
- Неметаллы при взаимодействии с металлами имеют тенденцию приобретать электроны (обычно , достигающий конфигурации электронов благородного газа) и превращаются в анионы :
Неметалл + Металл -> Соль
\ [3Br_ {2 (l)} + 2Al _ {(s)} \ rightarrow 2AlBr_ {3 (s)} \]
Оксид неметалла + вода -> кислота
\ [CO_ {2 (g)} + H_2O _ {(l)} \ rightarrow \ underset {\ text {carbonic acid}} {H_2CO_ {3 (aq)}} \]
(газированная вода слабо кислая)
- Неметаллические оксиды могут соединяться с основаниями с образованием солей.
Неметаллический оксид + основание -> соль
\ [CO_ {2 (g)} + 2NaOH _ {(aq)} \ rightarrow Na_2CO_ {3 (aq)} + H_2O _ {(l)} \]
Металлоиды
Свойства промежуточного между металлами и неметаллами. Металлоиды полезны в полупроводниковой промышленности.
| металлов | Неметаллы | металлоидов |
|---|---|---|
| золото | Кислород | Кремний |
| Серебро | Carbon | бор |
| Медь | Водород | Мышьяк |
| Железо | Азот | Сурьма |
| Меркурий | Сера |
примеров химических и физических свойств


Химическое свойство — это характеристика вещества, которую можно наблюдать и измерять только тогда, когда происходит химическая реакция. Сравните это с физическим свойством, которое является характеристикой, которую можно наблюдать и измерять без изменения химического состава образца.
Вот список нескольких примеров химических и физических свойств.
Химические свойства
Чтобы соблюдать химические свойства, химический состав образца должен быть изменен в результате химического процесса или реакции.
- воспламеняемость
- токсичность
- энтальпия образования
- теплота сгорания
- степени окисления
- pH
- период полураспада
- координационное число
- поверхностное натяжение
- реакционная способность
- гигроскопия
физические свойства
Физические свойства могут наблюдаться без изменения химической природы образца.Любое механическое свойство, которое вы можете назвать физическим свойством, в том числе:
- масса
- объем
- плотность
- цвет
- температура
- температура плавления
- точка кипения
- отражательная способность
- эластичность
- блеск
- проницаемость
- пластичность
- давление
- вязкость
- прочность
- растворимость
- электрический заряд
- непрозрачность
- твердость
