Виды растворов. Виды концентрации растворов
Растворы – это состоящая из двух или более веществ однородная масса или смесь, в которой одно вещество выступает в качестве растворителя, а другое – в качестве растворяемых частиц.
Существует две теории трактовки происхождения растворов: химическая, основоположником которой является Менделеев Д. И., и физическая, предложенная немецким и швейцарским физиками Оствальдом и Аррениусом. Согласно трактовке Менделеева, компоненты растворителя и растворяемого веществ становятся участниками химической реакции с образованием неустойчивых соединений этих самых компонентов или частиц.
Физическая же теория отрицает химическое взаимодействие между молекулами растворяющего и растворяемого веществ, объясняя процесс образования растворов как равномерное распределение частиц (молекул, ионов) растворителя между частицами растворяемой субстанции вследствие физического явления, именуемого диффузией.
Классификация растворов по различным критериям
На сегодня нет единой системы классификации растворов, однако условно виды растворов можно сгруппировать по наиболее значимым критериям, а именно:
I) По агрегатному состоянию выделяют: твёрдые, газообразные и жидкие растворы.
II) По размерам частиц растворённого вещества: коллоидные и истинные.
III) По степени концентрации частиц растворённого вещества в растворе: насыщенные, ненасыщенные, концентрированные, разбавленные.
IV) По способности проводить электрический ток: электролиты и неэлектролиты.
V) По назначению и области применения: химические, медицинские, строительные, специальные растворы и др.
Виды растворов по агрегатному состоянию
Классификация растворов по агрегатному состоянию растворителя приводится в широком смысле значения этого термина. Принято считать растворами жидкие субстанции (причём в качестве растворяемого вещества может выступать как жидкий, так и твёрдый элемент), однако если учесть тот факт, что раствор – это гомогенная система из двух или нескольких веществ, то вполне логично признать также и твёрдые растворы, и газообразные. Твёрдыми растворами принято считать смеси, например, нескольких металлов, больше известных в обиходе как сплавы. Газообразные виды растворов – это смеси нескольких газов, пример – окружающий нас воздух, который представлен в виде соединения кислорода, азота и углекислого газа.
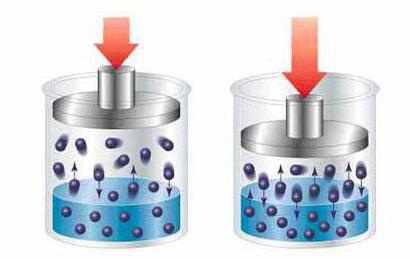
Растворы по размеру растворённых частиц
Виды растворов по размеру растворённых частиц включают истинные (обычные) растворы и коллоидные системы. В истинных растворах растворяемое вещество распадается на мелкие молекулы или атомы, по размерам приближённые к молекулам растворителя. При этом истинные виды растворов сохраняют первоначальные свойства растворителя, лишь слегка преображая его под действием физико-химических свойств добавленного в него элемента. Например: при растворении поваренной соли или сахара в воде вода остаётся в том же агрегатном состоянии и той же консистенции, практически такого же цвета, меняется только её вкус.

Коллоидные растворы отличаются от обычных тем, что добавляемый компонент распадается не полностью, сохраняя сложные молекулы и соединения, размеры которых значительно превышают частицы растворителя, превосходя значение 1 нанометра.
Виды концентрации растворов
В одно и то же количество растворителя можно добавить разное количество растворяемого элемента, на выходе будем иметь растворы с разной концентрацией. Перечислим основные из них:
- Насыщенные растворы характеризуются степенью растворимости вещества, при которой растворяемый компонент под влиянием постоянной величины температуры и давления больше не распадается на атомы и молекулы и раствор достигает фазового равновесия. Насыщенные растворы также условно можно разделить на концентрированные, в которых массовая доля растворённого компонента сопоставима с растворителем, и на разбавленные, где растворённого вещества в несколько раз меньше растворителя.
- Ненасыщенные – это те растворы, в которых растворяемое вещество ещё может распадаться на мелкие частицы.
- Пересыщенные растворы получаются тогда, когда изменяются параметры воздействующих факторов (температура, давление), в результате чего продолжается процесс «дробления» растворённого вещества, его становится больше, чем было при нормальных (обычных) условиях.
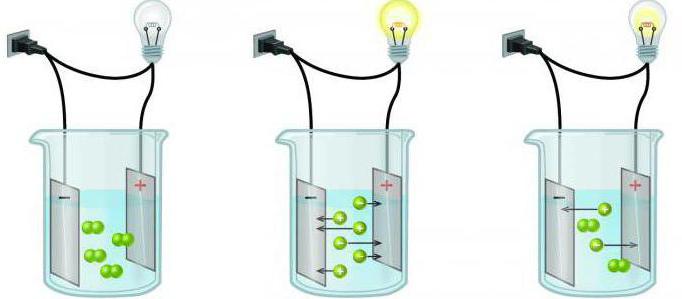
Электролиты и неэлектролиты
Некоторые вещества в растворах распадаются на ионы, способные проводить электрический ток. Такие гомогенные системы называются электролитами. В эту группу входят кислоты, большинство солей. А растворы, не проводящие электрический ток, принято называть неэлектролитами (почти все органические соединения).
Группы растворов по назначению
Растворы незаменимы во всех отраслях народного хозяйства, специфика которых создала такие виды специальных растворов, как медицинские, строительные, химические и другие.
Медицинские растворы – это совокупность препаратов в форме мазей, суспензий, микстур, растворов для инфузий и инъекций и прочих лекарственных форм, применяемых в медицинских целях для лечения и профилактики различных заболеваний.
Виды химических растворов включают в себя огромное множество гомогенных соединений, используемых в химических реакциях: кислоты, соли. Эти растворы могут быть органического или неорганического происхождения, водные (морская вода) или безводные (на основе бензола, ацетона и т. д.), жидкие (водка) или твёрдые (латунь). Они нашли своё применение в самых различных отраслях национального хозяйства: химическая, пищевая, текстильная промышленность.
Виды строительных растворов отличаются вязкой и густой консистенцией, из-за чего им больше подходит название смеси.
 Благодаря своей способности быстро затвердевать они с успехом применяются в качестве вяжущего материала для кладки стен, потолков, несущих конструкций, а также для отделочных работ. Представляют собой водные растворы, чаще всего трёхкомпонентные (растворитель, цемент различных маркировок, заполнитель), где в качестве наполнителя используется песок, глина, щебень, известь, гипс и другие строительные материалы.
Благодаря своей способности быстро затвердевать они с успехом применяются в качестве вяжущего материала для кладки стен, потолков, несущих конструкций, а также для отделочных работ. Представляют собой водные растворы, чаще всего трёхкомпонентные (растворитель, цемент различных маркировок, заполнитель), где в качестве наполнителя используется песок, глина, щебень, известь, гипс и другие строительные материалы.Растворы. Виды растворов — HimHelp.ru
Растворами называются гомогенные системы, содержащие не менее двух веществ. Могут существовать растворы твердых, жидких и газообразных веществ в жидких растворителях, а также однородные смеси (растворы) твердых, жидких и газообразных веществ. Как правило, вещество, взятое в избытке и в том же агрегатном состоянии, что и сам раствор, принято считать растворителем, а компонент, взятый в недостатке – растворенным веществом.
В зависимости от агрегатного состояния растворителя различают газообразные, жидкие и твердые растворы.
Газообразными растворами являются воздух и другие смеси газов.
К жидким растворам относят гомогенные смеси газов, жидкостей и твердых тел с жидкостями.
Твердыми растворами являются многие сплавы, например, металлов друг с другом, стёкла. Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость. Наиболее распространенным растворителем из неорганических веществ, конечно же, является вода. Из органических веществ в качестве растворителей используют метанол, этанол, диэтиловый эфир, ацетон, бензол, четыреххлористый углерод и др.
В процессе растворения частицы (ионы или молекулы) растворяемого вещества под действием хаотически движущихся частиц растворителя переходят в раствор, образуя в результате беспорядочного движения частиц качественно новую однородную систему. Способность к образованию растворов выражена у разных веществ в различной степени. Одни вещества способны смешиваться друг с другом в любых количествах (вода и спирт), другие – в ограниченных (хлорид натрия и вода).
Сущность процесса образования раствора можно показать на примере растворения твердого вещества в жидкости. С точки зрения молекулярно-кинетической теории растворение протекает следующим образом: при внесении в растворитель какого-либо твердого вещества, например, поваренной соли, частицы ионов Na
Частицы, перешедшие в раствор, вследствие диффузии распределяются по всему объему растворителя. С другой стороны, по мере увеличения концентрации частицы (ионы, молекулы), находящиеся в непрерывном движении, при столкновении с твердой поверхностью еще не растворившегося вещества могут задерживаться на ней, т.е. растворение всегда сопровождается обратным явлением – кристаллизацией. Может наступить такой момент, когда одновременно выделяется из раствора столько же частиц (ионов, молекул), сколько их переходит в раствор – наступает равновесие.
По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, – ненасыщенным.
Насыщенный раствор содержит максимально возможное (для данных условий) количество растворенного вещества. Следовательно, насыщенным раствором является такой раствор, который находится в равновесии с избытком растворенного вещества. Концентрация насыщенного раствора (растворимость) для данного вещества при строго определенных условиях (температура, растворитель) – величина постоянная.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным.
Насыщенный и ненасыщенный растворы нельзя путать с разбавленным и концентрированным. Разбавленные растворы – растворы с небольшим содержанием растворенного вещества; концентрированные растворы – растворы с большим содержанием растворенного вещества. Необходимо подчеркнуть, что понятие разбавленный и концентрированный растворы являются относительными, выражающими только соотношение количеств растворенного вещества и растворителя в растворе.
Сравнивая растворимость различных веществ, мы видим, что насыщенные растворы малорастворимых веществ являются разбавленными, а хорошо растворимых веществ – хотя и ненасыщенные, но довольно концентрированными.
В зависимости от того, электронейтральными или заряженными частицами являются компоненты раствора, их подразделяют на молекулярные (растворы неэлектролитов) и ионные (растворы электролитов). Одна из характерных особенностей растворов электролитов заключается в том, что они проводят электрический ток.
Раствор — это… Что такое Раствор?
 Растворение поваренной соли (NaCl) в воде
Растворение поваренной соли (NaCl) в водеРаство́р — гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. «Гомогенный» — значит, каждый из компонентов распределён в массе другого в виде своих частиц, то есть атомов, молекул или ионов.[1].
Раствор — однофазная система переменного, или гетерогенного, состава, состоящая из двух или более компонентов.
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает
Образование того или иного типа раствора обусловливается интенсивностью межмолекулярного, межатомного, межионного или другого вида взаимодействия, то есть, теми же силами, которые определяют возникновение того или иного агрегатного состояния. Отличия: образование раствора зависит от характера и интенсивности взаимодействия частиц разных веществ[1].
По сравнению с индивидуальными веществами по структуре растворы сложнее[1].
Растворы бывают газовыми, жидкими и твёрдыми
Твёрдые, жидкие, газообразные растворы
Чаще под раствором подразумевается жидкое вещество, например раствор соли или спирта в воде (или даже раствор золота в ртути — амальгама).
Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше.
В химической практике обычно под растворами понимают гомогенные системы, растворитель может быть жидким, твёрдым (твёрдый раствор), газообразным. Однако нередко допускается и микрогетерогенность — см. «Золи».
«Раствором» именуют и смесь цемента с водой, песком и так далее. Хотя это и не является раствором в химическом смысле этого слова.
Истинные и коллоидные растворы
Коллоидные и истинные растворы (изучением коллоидных систем занимается коллоидная химия) отличаются главным образом размерами частиц.
В истинных растворах размер частиц менее 1·10−9 м, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1·10−9 м — 5·10−7 м, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа (см. эффект Тиндаля).
Растворение
Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии при растворении твёрдых веществ и её уменьшением при растворении газов. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда — цвет, и другие) меняются.
В случае химического взаимодействия растворителя и растворённого вещества сильно меняются и химические свойства — например, при растворении газа хлороводорода в воде образуется жидкая соляная кислота.
Растворы электролитов и неэлектролитов
Электролиты — вещества, проводящие в расплавах или водных растворах электрический ток. В расплавах или водных растворах они диссоциируют на ионы. Неэлектролиты — вещества, водные растворы и расплавы которых не проводят электрический ток, так как их молекулы не диссоциируют на ионы. Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов).
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Растворы полимеров
Растворы высокомолекулярных веществ ВМС — белков, углеводов и др. обладают одновременно многими свойствами истинных и коллоидных растворов. Средняя молекулярная масса растворенноо…
В зависимости от цели для описания концентрации растворов используются разные физические величины.
В случаях приготовления растворов сильных кислот согласно правилам техники безопасности кислоту нужно добавлять в воду, но ни в коем случае не наоборот. Для запоминания этого лабораторного приёма существует несколько мнемонических правил:
Сначала вода,
Потом кислота,
Иначе случится
Большая бедаХимик, запомни как оду!
Льют кислоту в воду!
- Не плюй в кислоту, а то она ответит!
- Чай с лимоном (здесь нужно представить, как в чай Вы кладете дольку лимона).
«коньяк выдержанный» (кислоту в воду)
См. также
Примечания
Литература
- Streitwieser Andrew Introduction to Organic Chemistry. — 4th ed.. — Macmillan Publishing Company, New York, 1992. — ISBN ISBN 0-02-418170-6
РАСТВОРЫ | Энциклопедия Кругосвет
Содержание статьиРАСТВОРЫ, однофазные системы, состоящие из двух или более компонентов. По своему агрегатному состоянию растворы могут быть твердыми, жидкими или газообразными. Так, воздух – это газообразный раствор, гомогенная смесь газов; водка – жидкий раствор, смесь нескольких веществ, образующих одну жидкую фазу; морская вода – жидкий раствор, смесь твердого (соль) и жидкого (вода) веществ, образующих одну жидкую фазу; латунь – твердый раствор, смесь двух твердых веществ (меди и цинка), образующих одну твердую фазу. Смесь бензина и воды не является раствором, поскольку эти жидкости не растворяются друг в друге, оставаясь в виде двух жидких фаз с границей раздела. Компоненты растворов сохраняют свои уникальные свойства и не вступают в химические реакции между собой с образованием новых соединений. Так, при смешивании двух объемов водорода с одним объемом кислорода получается газообразный раствор. Если эту газовую смесь поджечь, то образуется новое вещество – вода, которая сама по себе раствором не является. Компонент, присутствующий в растворе в большем количестве, принято называть растворителем, остальные компоненты – растворенными веществами.
Однако иногда бывает трудно провести грань между физическим перемешиванием веществ и их химическим взаимодействием. Например, при смешивании газообразного хлороводорода HCl с водой H2O образуются ионы H3O+ и Cl–. Они притягивают к себе соседние молекулы воды, образуя гидраты. Таким образом, исходные компоненты – HCl и H2O – после смешивания претерпевают существенные изменения. Тем не менее ионизация и гидратация (в общем случае – сольватация) рассматриваются как физические процессы, происходящие при образовании растворов.
Одним из важнейших типов смесей, представляющих собой гомогенную фазу, являются коллоидные растворы: гели, золи, эмульсии и аэрозоли. Размер частиц в коллоидных растворах составляет 1–1000 нм, в истинных растворах ~0,1 нм (порядка размера молекул).
Основные понятия.
Два вещества, растворяющиеся друг в друге в любых пропорциях с образованием истинных растворов, называют полностью взаиморастворимыми. Такими веществами являются все газы, многие жидкости (например, этиловый спирт – вода, глицерин – вода, бензол – бензин), некоторые твердые вещества (например, серебро – золото). Для получения твердых растворов необходимо сначала расплавить исходные вещества, затем смешать их и дать затвердеть. При их полной взаиморастворимости образуется одна твердая фаза; если же растворимость частичная, то в образовавшемся твердом веществе сохраняются мелкие кристаллы одного из исходных компонентов.
Если два компонента образуют одну фазу при смешивании только в определенных пропорциях, а в других случаях возникают две фазы, то они называются частично взаиморастворимыми. Таковы, например, вода и бензол: истинные растворы получаются из них только при добавлении незначительного количества воды к большому объему бензола или незначительного количества бензола к большому объему воды. Если же смешать равные количества воды и бензола, то образуется двухфазная жидкая система. Нижний ее слой – это вода с небольшим количеством бензола, а верхний – бензол с малой примесью воды. Известны также вещества, совсем не растворяющиеся одно в другом, например, вода и ртуть. Если два вещества лишь частично взаиморастворимы, то при данных температуре и давлении существует предельное количество одного вещества, которое способно образовать истинный раствор с другим в равновесных условиях. Раствор с предельной концентрацией растворенного вещества называют насыщенным. Можно приготовить и так называемый пересыщенный раствор, в котором концентрация растворенного вещества даже больше, чем в насыщенном. Однако пересыщенные растворы неустойчивы, и при малейшем изменении условий, например при перемешивании, попадании частичек пыли или добавлении кристалликов растворяемого вещества, избыток растворенного вещества выпадает в осадок.
Всякая жидкость начинает кипеть при той температуре, при которой давление ее насыщенного пара достигает величины внешнего давления. Например, вода под давлением 101,3 кПа кипит при 100° С потому, что при этой температуре давление водяного пара как раз равно 101,3 кПа. Если же растворить в воде какое-нибудь нелетучее вещество, то давление ее пара понизится. Чтобы довести давление пара полученного раствора до 101,3 кПа, нужно нагреть раствор выше 100° С. Отсюда следует, что температура кипения раствора всегда выше температуры кипения чистого растворителя. Аналогично объясняется и понижение температуры замерзания растворов.
Закон Рауля.
В 1887 французский физик Ф.Рауль, изучая растворы различных нелетучих жидкостей и твердых веществ, установил закон, связывающий понижение давления пара над разбавленными растворами неэлектролитов с концентрацией: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. Из закона Рауля следует, что повышение температуры кипения или понижение температуры замерзания разбавленного раствора по сравнению с чистым растворителем пропорционально молярной концентрации (или мольной доле) растворенного вещества и может быть использовано для определения его молекулярной массы.
Раствор, поведение которого подчиняется закону Рауля, называется идеальным. Наиболее близки к идеальным растворы неполярных газов и жидкостей (молекулы которых не меняют ориентации в электрическом поле). В этом случае теплота растворения равна нулю, а свойства растворов можно прямо предсказать, зная свойства исходных компонентов и пропорции, в которых они смешиваются. Для реальных растворов сделать такое предсказание нельзя. При образовании реальных растворов обычно выделяется или поглощается тепло. Процессы с выделением тепла называются экзотермическими, а с поглощением – эндотермическими.
Те характеристики раствора, которые зависят в основном от его концентрации (числа молекул растворенного вещества на единицу объема или массы растворителя), а не от природы растворенного вещества, называют коллигативными. Например, температура кипения чистой воды при нормальном атмосферном давлении равна 100° С, а температура кипения раствора, содержащего 1 моль растворенного (недиссоциирующего) вещества в 1000 г воды, составляет уже 100,52° С независимо от природы этого вещества. Если же вещество диссоциирует, образуя ионы, то температура кипения увеличивается пропорционально росту общего числа частиц растворенного вещества, которое благодаря диссоциации превышает число молекул вещества, добавленных в раствор. Другими важными коллигативными величинами являются температура замерзания раствора, осмотическое давление и парциальное давление паров растворителя.
Концентрация раствора
– это величина, отражающая пропорции между растворенным веществом и растворителем. Такие качественные понятия, как «разбавленный» и «концентрированный», говорят только о том, что раствор содержит мало или много растворенного вещества. Для количественного выражения концентрации растворов часто используют проценты (массовые или объемные), а в научной литературе – число молей или химических эквивалентов (см. ЭКВИВАЛЕНТНАЯ МАССА) растворенного вещества на единицу массы или объема растворителя либо раствора. Чтобы не возникало путаницы, следует всегда точно указывать единицы измерения концентрации. Рассмотрим следующий пример. Раствор, состоящий из 90 г воды (ее объем равен 90 мл, поскольку плотность воды равна 1г/мл) и 10 г этилового спирта (его объем равен 12,6 мл, поскольку плотность спирта равна 0,794 г/мл), имеет массу 100 г, но объем этого раствора равен 101,6 мл (а был бы равен 102,6 мл, если бы при смешивании воды и спирта их объемы просто складывались). Процентную концентрацию раствора можно рассчитать по-разному:

или


или


Единицы концентраций, используемые в научной литературе, основаны на таких понятиях, как моль и эквивалент, поскольку все химические расчеты и уравнения химических реакций должны основываться на том, что вещества вступают в реакции между собой в определенных соотношениях. Например, 1 экв. NaCl, равный 58,5 г, взаимодействует с 1 экв. AgNO3, равным 170 г. Ясно, что растворы, содержащие по 1 экв. этих веществ, имеют совершенно разные процентные концентрации.
Молярность
(M или моль/л) – число молей растворенного веществ, содержащихся в 1 л раствора.
Моляльность
(м) – число молей растворенного вещества, содержащихся в 1000 г растворителя.
Нормальность
(н.) – число химических эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Мольная доля
(безразмерная величина) – число молей данного компонента, отнесенное к общему числу молей растворенного вещества и растворителя. (Мольный процент – мольная доля, умноженная на 100.)
Наиболее распространенная единица – молярность, но при ее расчете следует учитывать некоторые неоднозначности. Например, чтобы получить 1M раствор данного вещества, растворяют в заведомо небольшом количестве воды точную его навеску, равную мол. массе в граммах, и доводят объем раствора до 1 л. Количество воды, необходимое для приготовления данного раствора, может слегка различаться в зависимости от температуры и давления. Поэтому два одномолярных раствора, приготовленных в разных условиях, в действительности имеют не совсем одинаковые концентрации. Моляльность вычисляется исходя из определенной массы растворителя (1000 г), которая не зависит от температуры и давления. В лабораторной практике гораздо удобнее отмеривать определенные объемы жидкостей (для этого существуют бюретки, пипетки, мерные колбы), чем взвешивать их, поэтому в научной литературе концентрации чаще выражают в молях, а моляльность обычно применяют только при особо точных измерениях.
Нормальность используется для упрощения расчетов. Как мы уже говорили, вещества взаимодействуют друг с другом в количествах, соответствующих их эквивалентам. Приготовив растворы разных веществ одинаковой нормальности и взяв равные их объемы, мы можем быть уверены в том, что они содержат одно и то же количество эквивалентов.
В тех случаях, когда трудно (или нет необходимости) делать различие между растворителем и растворенным веществом, концентрацию измеряют в мольных долях. Мольные доли, как и моляльности, не зависят от температуры и давления.
Зная плотности растворенного вещества и раствора, можно пересчитать одну концентрацию в другую: молярность в моляльность, мольную долю и наоборот. Для разбавленных растворов данного растворенного вещества и растворителя эти три величины пропорциональны друг другу.
Растворимость
данного вещества – это его способность образовывать растворы с другими веществами. Количественно растворимость газа, жидкости или твердого тела измеряется концентрацией их насыщенного раствора при данной температуре. Это важная характеристика вещества, помогающая понять его природу, а также влиять на ход реакций, в которых это вещество участвует.
Газы.
В отсутствие химического взаимодействия газы смешиваются друг с другом в любых пропорциях, и в этом случае говорить о насыщении нет смысла. Однако при растворении газа в жидкости существует некая предельная концентрация, зависящая от давления и температуры. Растворимость газов в некоторых жидкостях коррелирует с их способностью к сжижению. Наиболее легко сжижаемые газы, например NH3, HCl, SO2, более растворимы, чем трудно сжижаемые газы, например O2, H2 и He. При наличии химического взаимодействия между растворителем и газом (например, между водой и NH3 или HCl) растворимость увеличивается. Растворимость данного газа изменяется с природой растворителя, однако порядок, в котором располагаются газы в соответствии с увеличением их растворимости, остается примерно одинаковым для разных растворителей.
Процесс растворения подчиняется принципу Ле Шателье (1884): если на систему, находящуюся в равновесии, оказывается какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится. Растворение газов в жидкостях обычно сопровождается выделением тепла. При этом, в соответствии с принципом Ле Шателье, растворимость газов уменьшается. Это уменьшение тем заметнее, чем выше растворимость газов: такие газы имеют и бóльшую теплоту растворения. «Мягкий» вкус кипяченой или дистиллированной воды объясняется отсутствием в ней воздуха, поскольку его растворимость при высокой температуре весьма мала.
С ростом давления растворимость газов увеличивается. Согласно закону Генри (1803), масса газа, который может раствориться в данном объеме жидкости при постоянной температуре, пропорциональна его давлению. Это свойство используется для приготовления газированных напитков. Углекислый газ растворяют в жидкости при давлении 3–4 атм.; в этих условиях в данном объеме может раствориться в 3–4 раза больше газа (по массе), чем при 1 атм. Когда емкость с такой жидкостью открывают, давление в ней падает, и часть растворенного газа выделяется в виде пузырьков. Аналогичный эффект наблюдается при открывании бутылки шампанского или выходе на поверхность подземных вод, насыщенных на большой глубине углекислым газом.
При растворении в одной жидкости смеси газов растворимость каждого из них остается такой же, как и в отсутствие других компонентов при таком же давлении, как в случае смеси (закон Дальтона).
Жидкости.
Взаимная растворимость двух жидкостей определяется тем, насколько сходно строение их молекул («подобное растворяется в подобном»). Для неполярных жидкостей, например углеводородов, характерны слабые межмолекулярные взаимодействия, поэтому молекулы одной жидкости легко проникают между молекулами другой, т.е. жидкости хорошо смешиваются. Напротив, полярные и неполярные жидкости, например вода и углеводороды, смешиваются друг с другом плохо. Каждой молекуле воды нужно сначала вырваться из окружения других таких же молекул, сильно притягивающими ее к себе, и проникнуть между молекулами углеводорода, притягивающими ее слабо. И наоборот, молекулы углеводорода, чтобы раствориться в воде, должны протиснуться между молекулами воды, преодолевая их сильное взаимное притяжение, а для этого нужна энергия. При повышении температуры кинетическая энергия молекул возрастает, межмолекулярное взаимодействие ослабевает и растворимость воды и углеводородов увеличивается. При значительном повышении температуры можно добиться их полной взаимной растворимости. Такую температуру называют верхней критической температурой растворения (ВКТР).
В некоторых случаях взаимная растворимость двух частично смешивающихся жидкостей увеличивается при понижении температуры. Этот эффект наблюдается в том случае, когда при смешивании выделяется тепло, обычно в результате химической реакции. При значительном понижении температуры, но не ниже точки замерзания, можно достичь нижней критической температуры растворения (НКТР). Можно предположить, что все системы, имеющие НКТР, имеют и ВКТР (обратное не обязательно). Однако в большинстве случаев одна из смешивающихся жидкостей кипит при температуре ниже ВКТР. У системы никотин–вода НКТР равна 61° С, а ВКТР составляет 208° C. В интервале 61–208° C эти жидкости ограниченно растворимы, а вне этого интервала обладают полной взаимной растворимостью.
Твердые вещества.
Все твердые вещества проявляют ограниченную растворимость в жидкостях. Их насыщенные растворы имеют при данной температуре определенный состав, который зависит от природы растворенного вещества и растворителя. Так, растворимость хлорида натрия в воде в несколько миллионов раз выше растворимости нафталина в воде, а при растворении их в бензоле наблюдается обратная картина. Этот пример иллюстрирует общее правило, согласно которому твердое вещество легко растворяется в жидкости, имеющей с ним сходные химические и физические свойства, но не растворяется в жидкости с противоположными свойствами.
Соли обычно легко растворяются в воде и хуже – в других полярных растворителях, например в спирте и жидком аммиаке. Однако растворимость солей тоже существенно различается: например, нитрат аммония обладает в миллионы раз большей растворимостью в воде, чем хлорид серебра.
Растворение твердых веществ в жидкостях обычно сопровождается поглощением тепла, и в соответствии с принципом Ле Шателье их растворимость должна увеличиваться при нагревании. Этот эффект можно использовать для очистки веществ методом перекристаллизации. Для этого их растворяют при высокой температуре до получения насыщенного раствора, затем раствор охлаждают и после выпадения растворенного вещества в осадок профильтровывают. Есть вещества (например, гидроксид, сульфат и ацетат кальция), растворимость которых в воде с ростом температуры уменьшается.
Твердые вещества, как и жидкости, тоже могут растворяться друг в друге полностью, образуя гомогенную смесь – истинный твердый раствор, аналогичный жидкому раствору. Частично растворимые друг в друге вещества образуют два равновесных сопряженных твердых раствора, составы которых изменяются с температурой.
Коэффициент распределения.
Если к равновесной системе двух несмешивающихся или частично смешивающихся жидкостей добавить раствор какого-либо вещества, то оно распределяется между жидкостями в определенной пропорции, не зависящей от общего количества вещества, в отсутствие химических взаимодействий в системе. Это правило получило название закона распределения, а отношение концентраций растворенного вещества в жидкостях – коэффициента распределения. Коэффициент распределения примерно равен отношению растворимостей данного вещества в двух жидкостях, т.е. вещество распределяется между жидкостями соответственно его растворимостям. Это свойство используется для экстракции данного вещества из его раствора в одном растворителе с помощью другого растворителя. Еще одним примером его применения является процесс экстракции серебра из руд, в состав которых оно часто входит вместе со свинцом. Для этого в расплавленную руду добавляют цинк, который не смешивается со свинцом. Серебро распределяется между расплавленным свинцом и цинком, преимущественно в верхнем слое последнего. Этот слой собирают и отделяют серебро дистилляцией цинка.
Произведение растворимости
(ПР). Между избытком (осадком) твердого вещества MxBy и его насыщенным раствором устанавливается динамическое равновесие, описываемое уравнением
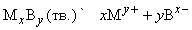
Константа равновесия этой реакции равна
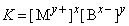
и называется произведением растворимости. Она постоянна при данных температуре и давлении и является величиной, на основании которой рассчитывают растворимость осадка и изменяют ее. Если в раствор добавить соединение, диссоциирующее на ионы, одноименные с ионами малорастворимой соли, то в соответствии с выражением для ПР растворимость соли уменьшается. При добавлении же соединения, реагирующего с одним из ионов, она, напротив, увеличится.
О некоторых свойствах растворов ионных соединений см. также ЭЛЕКТРОЛИТЫ.
Раствор — Википедия
 Растворение поваренной соли (NaCl) в воде
Растворение поваренной соли (NaCl) в водеРаство́р — гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. «Гомогенный» — значит, что каждый из компонентов распределен в массе другого в виде своих частиц, то есть атомов, молекул или ионов[1].
Раствор — однофазная система переменного, или гетерогенного, состава, состоящая из двух или более компонентов.
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает[1].
Образование того или иного типа раствора обусловливается интенсивностью межмолекулярного, межатомного, межионного или другого вида взаимодействия, то есть теми же силами, которые определяют возникновение того или иного агрегатного состояния. Отличия: образование раствора зависит от характера и интенсивности взаимодействия частиц разных веществ[1].
По сравнению с индивидуальными веществами по структуре растворы сложнее[1].
Химическое взаимодействие растворенного вещества с водой приводит к образованию соединений, которые называются гидратами. Их формулы выражают с помощью формул растворенного вещества и воды, соединённых знаком «.»
Гидратную теорию растворов предложил русский учёный Д. И. Менделеев.
Гидратация — процесс взаимодействия растворяемого вещества с водой.
Кристаллогидраты — кристаллы, в состав которых входят молекулы воды; вода, содержащаяся в кристаллогидратах, — кристаллизационная.
Твёрдые, жидкие, газообразные растворы
Чаще всего под раствором подразумевается жидкое вещество, например, раствор соли или спирта в воде (или даже раствор золота в ртути — амальгама).
Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше.
В химической практике обычно под растворами понимают гомогенные системы, растворитель может быть жидким (водный раствор), твёрдым (твёрдый раствор), газообразным. Однако нередко допускается и гетерогенность — см. «Золи».
«Раствором» именуют и смесь цемента с водой, песком и так далее. Хотя это и не является раствором в химическом смысле этого слова.
Истинные и коллоидные растворы
Коллоидные и истинные/молекулярные растворы (изучением коллоидных систем занимается коллоидная химия) отличаются главным образом размерами частиц.
В истинных растворах размер частиц менее 1 нм, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1 нм — 500000 нм, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа (см. эффект Тиндаля).
Растворение
Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии при растворении твёрдых веществ и её уменьшением при растворении газов. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда — цвет, и другие) меняются.
В случае химического взаимодействия растворителя и растворённого вещества сильно меняются и химические свойства — например, при растворении газа хлороводорода в воде образуется жидкая соляная кислота.
При растворении кристаллических веществ, растворимость которых увеличивается с увеличением температуры, происходит охлаждение раствора ввиду того, что у раствора внутренняя энергия больше, чем у кристаллического вещества и растворителя, взятых отдельно. Например, кипяток, в котором растворяют сахар, сильно охлаждается[2].
Растворы электролитов и неэлектролитов
Электролиты — вещества, проводящие в расплавах или водных растворах электрический ток. В расплавах или водных растворах они диссоциируют на ионы.
Неэлектролиты — вещества, водные растворы и расплавы которых не проводят электрический ток, так как их молекулы не диссоциируют на ионы. Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов).
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Растворы полимеров
Растворы высокомолекулярных веществ ВМС — белков, углеводов и др. обладают одновременно многими свойствами истинных и коллоидных растворов.
В зависимости от цели для описания концентрации растворов используются разные физические величины.
- Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить ещё некоторое его количество.
- Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе.
- Пересыщенный раствор (изредка используется термин перенасыщенный) — раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе. Пересыщенные растворы неустойчивы, избыток вещества легко выпадает в осадок. Такой раствор нельзя получить путём растворения в нормальных условиях, обычно пересыщенный раствор получают охлаждением раствора, насыщенного при более высокой температуре (пересыщение).
- Концентрированный раствор — раствор с высоким содержанием растворённого вещества в противоположность разбавленному раствору, содержащему малое количество растворённого вещества. Деление растворов на концентрированные и разбавленные не связано с делением на насыщенные и ненасыщеные. Так насыщенный 0,0000134М раствор хлорида серебра является очень разбавленным, а 4М раствор бромида калия, будучи очень концентрированным, не является насыщенным.
- Разбавленный раствор — раствор с низким содержанием растворённого вещества. Отметим, что не всегда разбавленный раствор является ненасыщенным — например, насыщенный 0,0000134М раствор практически нерастворимого хлорида серебра является очень разбавленным. Граница между разбавленным и концентрированным растворами весьма условна.
См. также
Примечания
Литература
- Шахпаронов М. И. Введение в молекулярную теорию растворов. — М.: Государственное издательство технико-теоретической литературы, 1956. — 508 с.
- Реми Г. Курс неорганической химии. — М.: Издательство иностранной литературы, 1963, 1966. — Т. 1—2.
- Streitwieser, Andrew. Introduction to Organic Chemistry. — 4th ed. — Macmillan Publishing Company, New York, 1992. — ISBN ISBN 0-02-418170-6.
Ссылки
Истинные растворы характеризуются молекулярной или ионной степенью дисперсности, в растворах высокомолекулярных соединений образуются макромолекулы или их ассоциации, коллоидные растворы отличаются наличием мицелл растворенного вещества.
Истинные растворы. Такие растворы характеризуются полной гомогенностью благодаря одинаковым размерам частиц растворенного вещества и растворителя и отсутствию поверхностей раздела между ними. Истинные растворы — это однофазные дисперсные системы. Истинные растворы характеризуются большой прочностью связи между растворенной жидкостью и растворителем. Растворенная жидкость (вещество) в дальнейшем не отделяется от растворителя, остается равномерно распределенной в растворителе. Истинный раствор сохраняет гомогенность неопределенно долгое время, если только в нем не происходит никаких самопроизвольных вторичных процессов (например, гидролиза, окисления, фотосинтеза). Истинные растворы бывают ионно-дисперсными и молекулярно-дисперсными. Размер частиц в первых составляет менее 1 нм, а растворенное вещество находится в виде отдельных гидратированных ионов и молекул в равновесных количествах. Истинные растворы всегда прозрачны, они не должны содержать взвешенных частиц и осадка. Особенностью истинных растворов является то, что они гомогенны даже при рассматривании в электронный микроскоп. Компоненты, входящие в их состав, не могут быть разделены никаким способом. Истинные растворы хорошо диффундируют. К этой группе относятся растворы электролитов и неэлектролитов, таких как глюкоза, натрия хлорид, спирт, магния сульфат и т.д.
Истинные растворы высокомолекулярных соединений являются молекулярно-дисперсными системами, которые образованы дифильными макромолекулами. С одной стороны, они являются однофазными гомогенными системами (как и истинные растворы), а с другой — имеют некоторые особенности, сближающие их с коллоидными растворами (движение молекул, подобное броуновскому, малые скорости диффузии, неспособность к диализу, повышенная способность к образованию молекулярных комплексов и некоторые другие).
Коллоидные растворы. Коллоидный раствор — это гетерогенная дисперсионная система, в которой частицы растворенного вещества обладают ультрамикроскопической (коллоидной) степенью дробления. Размер частиц дисперсной фазы составляет 1—100 нм. Даже электронные иммерсионные микроскопы не всегда дают возможность визуально обнаружить частицы дисперсионной фазы коллоидных растворов. К коллоидным растворам относятся золи, размер частиц в них достаточно велик и составляет более 1/2 длины световой волны, поэтому свет не может свободно проходить через них и подвергается большему или меньшему рассеиванию. Благодаря светорассеянию золи характеризуются феноменом Тиндаля, т.е. всегда, особенно в отраженном свете, кажутся опалесцирующими, мутными. В отличие от истинных растворов золи обладают очень малым осмотическим давлением и, как следствие, высокой степенью лабильности. Элементарными единицами в золях являются сложные структурные электронейтральные агрегаты — мицеллы. Мицеллы находятся в состоянии электролитической диссоциации и состоят из массивного поливалентного иона — гранулы и соответствующего количества противоположно заряженных ионов обычного размера — противоионов. Ядро гранулы представляет собой кристаллический комплекс электронейтральных атомов или молекул. Наружная (активная) часть гранулы является адсорбционной оболочкой (сферой). Она состоит из ионов одного знака. Противоионы располагаются в интермицеллярной жидкости по соседству с гранулами и имеют некоторую возможность самостоятельного движения. Такое строение золей обусловливает и их свойства.
Как известно, под влиянием часто незначительных причин (таких как прибавление воды, растворов электролитов, нагревание, механическое встряхивание, свет, повышение температуры), а иногда и вообще самопроизвольно коллоидные растворы подвергаются разрушению — коагуляции. При коагуляции частицы растворенного вещества укрупняются, золь сильно мутнеет, превращается в суспензию, а спустя некоторое время, выпадает осадок — коагулянт. Даже при самых бережных условиях хранения золи имеют ограниченный срок существования. Особым случаем образования жидких коллоидных систем, состоящих в пограничной области между золями и суспензиями, являются тонкие мути, обозначаемые в фармацевтической практике особым термином — “турбидные микстуры” (от лат. turbide — “мутный”). Наиболее типичными случаями образования тонких мутей являются случаи разведения водными растворами многих спиртовых настоек и некоторых жидких экстрактов, а также случаи разведения водными растворителями многих спиртовых растворов, особенно имеющих концентрацию, близкую к насыщенной. Спиртовые извлечения из растительного сырья, к числу которых относятся настойки и жидкие экстракты, часто содержат сложные комплексы разнообразных компонентов растворимых и нерастворимых в воде. К числу труднорастворимых или нерастворимых в воде экстрактивных веществ, характерных для многих настоек и жидких экстрактов, относятся эфирные масла, стеарины, воск, жиры, хлорофилл и т.д. В спиртовых средах эти вещества находятся в состоянии истинного раствора. При смешивании спиртовых настоек и многих жидких экстрактов с водой концентрация спирта понижается, растворимость водонерастворимых веществ уменьшается, и наконец, они выделяются из первичного раствора, образуя гетерогенные системы. В зависимости от количества замены одного растворителя другим (спирта водой) выделение водонерастворимых веществ происходит различно и приводит к образованию систем с различной степенью дисперсности — золей, мутей, эмульсий. С технологической точки зрения желательно получить гетерогенные системы с возможно высокой степенью дисперсности водонерастворимых компонентов в жидкости. Существуют две возможности образования дисперсных систем. Первая реализуется при постепенном прибавлении к первоначальному спиртовому раствору воды, вторая — при прибавлении первоначального спиртового раствора к значительному количеству воды. Первый случай характеризуется сравнительно медленным понижением концентрации спирта, поэтому раствор водонерастворимого вещества доводится до насыщения, а затем превращается в пересыщенный раствор, из которого начинается относительно медленное выделение водонерастворимых компонентов в виде нерастворимой фазы. В таком случае в результате изменения растворяющей способности растворителя происходит процесс, напоминающий относительно упорядочную кристаллизацию. Новые порции выделяющегося вещества отмечаются преимущественно на поверхности ранее выделившихся частиц, играющих роль кристаллизационных центров. В результате образующиеся частицы дисперсной фазы увеличиваются до значительных размеров, превращаясь в довольно грубую, сравнительно быстроотслаивающуюся суспензию. Во втором случае первоначальный спиртовой раствор, попадая в избыток водного растворителя, разбавляется последним быстро. Также быстро выделяется нерастворимая фаза.
В этом случае трудно предполагать упорядоченное выделение водонепроницаемого вещества, сходного с упорядоченной кристаллизацией. Частицам, попадающим в условия резкого перепада концентрации спирта, не остается времени для роста, и они выделяются в виде тончайшей коллоидной мути, тем более тонкой, чем меньше растворимость выделяющейся дисперсной фазы в новом растворителе, образовавшемся при смешении жидкостей.
С технологической точки зрения второй случай является наиболее приемлемым. Необходимо иметь в виду, что дальнейшая судьба нерастворимой фазы сильно зависит от состава раствора, в котором она образовалась. Так как в большинстве случаев водонерастворимые вещества, содержащиеся в спиртовых извлечениях из растительных материалов, обладают кислотным характером, щелочная реакция микстуры, содержащей, например, натрия гидрокарбонат, способствует возникновению дзета-потенциала нерастворимых частиц и оказывает стабилизирующее влияние. Таким же действием обладают многие углеводы и их производные (слизи, камеди), сапонины, глицерин и другие вещества, способствующие повышению гидрофильности поверхностного слоя водонерастворимых гранул и приводящие к их гидратации.
В присутствии значительного количества нейтральных соединений устойчивость дисперсионной системы часто понижается вплоть до коагуляции. Чем выше концентрация нейтральных соединений, тем больше эта опасность. По указанной причине совершенно неправильным способом является работа, при которой сначала отмеривают нейтральное соединение (например, концентрированные растворы солей), а потом добавляют к ним настойки или жидкие экстракты. В результате возникают грубодисперсные системы.
Суспензии (suspensio) — это такие системы, которые состоят из раздробленного твердого вещества и жидкой фазы. Размер частиц в них колеблется от 0,1 до 50 мкм и более (грубодисперсные системы). Суспензии гетерогенны, но в отличие от коллоидных растворов это мутные жидкости, частицы которых видны под обычным микроскопом. Эти жидкости седиментируют, их частицы задерживаются даже крупнопористыми фильтрующими материалами. Они не склонны к диализу и диффузии.
Эмульсии (emulsus) представляют собой дисперсные системы, в которых и дисперсная фаза, и дисперсионная среда представлены взаимонерастворимыми или мало взаиморастворимыми жидкостями. Эмульсии относятся к грубодисперсным системам, в которых размер дисперсных частиц (капелек) колеблется в пределах от 1 до 150 мкм, но в некоторых случаях они бывают и более высокодисперсными.
Между тремя последними дисперсными системами нельзя провести четкую грань, что часто вызывает затруднения при прописи жидких лекарственных препаратов.
Комбинированныe дисперсныe системы включают экстракционные лекарственные формы (настои, отвары, слизи). В них действующие вещества могут находиться как в растворенном виде, так и в виде тонких суспензий и эмульсий. Кроме того, комбинированные дисперсные системы могут получаться в результате сочетаний веществ, по-разному распределяющихся в жидкой среде.
Жидкие лекарственные формы делят на препараты для наружного, внутреннего и инъекционного применения. Жидкие лекарственные формы для внутреннего применения называются микстурами (от лат. mixturae — “смешивать”), дисперсионной средой в них является только вода. Микстуры содержат три ингредиента и более. Грубые дисперсии (частицы размером 5—10 мкм), быстрооседающие и поэтому перед употреблением взбалтываемые, в аптечной практике обычно называют взбалтываемыми микстурами — mixturae agitandae (от лат. agito — “трясти”). Более тонкие растворы, по степени дисперсности приближающиеся к золям, называют микстурами мутными — mixturae turbidae (от лат. turbidus — “мутный”).
Микстуры, как правило, дозируются столовыми (15 мл), десертными (10 мл) и чайными (5 мл) ложками. Растворы для приема внутрь назначают обычно в количестве 5—15 мл, а также в каплях, которые перед употреблением разводят небольшим количеством воды или молока (масляные растворы).
Для применения раствора необходимо определить:
- концентрацию раствора;
общее количество раствора.
Например, если вам выписали раствор кальция хлорида на 5 дней с таким расчетом, чтобы, применяя его внутрь по 1 ст. л., вы получали бы по 1,5 г кальция хлорида, то принимать его нужно по 1 ст. л. 4 раза в день.
Расчет концентрации раствора в процентах: 1 ст. л. — 15 мл — содержит 1,5 г вещества, т.е. раствор 10%-ный.
Расчет количества раствора. Вы будете принимать раствор по 1 ст. л. 4 раза в день в течение 5 дней, всего 20 ст. л. В 1 ст. л. —15 мл.
Следовательно, общее количество раствора — 300 мл.
При использовании внутрь лекарственных средств в каплях, достигается только приблизительная точность дозировки, так как величина капли может варьировать в зависимости от поверхностного натяжения жидкости, толщины края склянки и формы различных капельниц.
Поэтому при дозировании веществ каплями следует избегать назначения максимальных доз для ядовитых и сильнодействующих веществ, так как может произойти передозировка препарата и возникнуть отравление или аллергическая реакция.
Жидкие лекарственные формы для наружного применения назначаются в виде полосканий, примочек, растираний, клизм, капель. Дисперсионной средой в них, кроме воды, могут быть этанол, глицерин, различные масла и другие жидкости.
Помимо этого, жидкие лекарственные формы классифицируют по составу на простые (включающие одно лекарственное вещество) и сложные (в состав входит несколько ингредиентов), а также по природе жидкой среды — на водные и неводные. Более подробно об отдельных видах растворов будет рассказано ниже.
Растворы характеристика растворов — Знаешь как
Что такое раствор
 Растворы имеют весьма важное значение в жизни и практической деятельности человека. Достаточно указать, что процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор.
Растворы имеют весьма важное значение в жизни и практической деятельности человека. Достаточно указать, что процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор.
Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т. д.). Наконец, все производства, в основе которых лежат химические процессы, связаны в той или иной мере с использованием различных растворов.
Раствор находиться в промежуточном состоянии между химическими и механическими смесями, а также бывают пересыщенными.
Пересыщенные растворы
Это неустойчивые системы, которые могут существовать только при условии, что в состав раствора не входят твердые частицы растворенного вещества.
Это явление открыл русский академик Т. Е. Ловицем (1794 г.), который назвал такие растворы пересыщенными.
Он провел опыт с медленным охлаждением растворенного вещества, позаботившись о там , чтобы в него не попали твердые частицы растворенного вещества. Так при удачном опыте добавление кристалла того вещества, то во круг него за счет пересыщенного состояния начинают образовываться другие кристаллы.
Иногда кристаллизация образовывалась от простого сотрясения, удара или трения палочки стенки. Это явление протекало с выделением значительного количества тепла.
 Механизм растворения соли
Механизм растворения солиПовседневно сталкиваясь с растворами, человек давно интересовался их свойствами, однако основные закономерности, определяющие поведение растворов, были установлены только в XVIII веке.
Много внимания уделял изучению растворов М. В. Ломоносов. Он исследовал влияние температуры на растворение различных веществ, тепловые явления при растворении, замерзание растворов, явления кристаллизации и др.
Он же установил, что процесс растворения всегда сопровождается энергетическим эффектом и в связи с этим указал на необходимость строго различать два случая растворения: а) растворение, сопровождающееся выделением тепла, как, например, растворение металлов в кислотах, являющееся по существу химическим взаимодействием кислоты с металлом, так как при выпаривании раствора выделяется не взятый металл, а его соль, образованная данной кислотой; б) растворение, идущее с поглощением тепла, как, например, растворение соли в воде, при котором не происходит химического изменения растворяемого вещества и при выпаривании раствора кристаллизуется та же соль, которая была взята для растворения.
Растворы характеристика растворов
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут изменяться в довольно широких пределах. Наиболее важный вид растворов — это жидкие растворы, рассмотрению которых и посвящается настоящий раздел.
Всякий раствор состоит из растворенного вещества и растворителя, т. е. среды, в которой это вещество равномерно распределено в виде молекул или еще более мелких частиц — ионов. Однако не всегда легко определить, какое вещество является растворителем и какое — растворенным веществом.
Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор (например, в случае водного раствора соли растворителем, конечно, является вода).
Если оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Однородность растворов делает их очень сходными с химическими соединениями. Выделение тепла при растворении некоторых веществ тоже указывает на известного рода химическое взаимодействие между растворителем и растворяемым веществом.
Отличие растворов от химических соединений состоит в том, что состав последних постоянен, а состав раствора, приготовленного из данных компонентов, может иногда изменяться в довольно широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения.
Непостоянство состава растворов приближает их к механическим смесям, однако от последних они резко отличаются своею однородностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями.
Коллоидные растворы
Это растворы которые отличаются свойствами от истинных растворов и грубодисперсных систем. Примером коллоидного раствора может быть растворенное в воде мыло, а если его растворить в спирте то это будет истинный.
Отличить истинный раствор от коллоидного можно проделав опыт с банкой у которой нет дна, его нужно закрыть пергаментом и налить в него раствор хлорида натрия.
Опустить банку с водой и через время вкус воды станет соленым, а если в место хлорида натрия добавить белок от яйца, то его не обнаружится во второй банке. Коллоидные растворы не могут проникать через перегородки, а истинные да.
Поэтому этим свойством пользуются для отделения истинных растворов (примеси растворимых солей), от коллоидных растворов.
73 74 75
Вы читаете, статья на тему Растворы характеристика растворов
типов решений — концепция
Растворы представляют собой гомогенные смеси. Различные растворы содержат растворители и растворенные вещества в разных фазах. Растворенные вещества растворяются в растворителе. В растворе, в котором диоксид углерода растворяется в воде, вода является растворителем, а диоксид углерода — растворенным. При изучении химических растворов важны две концепции: концентрация раствора и равновесие растворимости. Свойства решений в целом называют коллигативными свойствами.
Хорошо. Давайте поговорим о различных типах решений, которые вы увидите. Не забывайте, что решение на самом деле является однородной смесью, что означает, что внутри решения есть вещи, не связанные между собой. Они просто в некотором роде, их притягивают друг к другу таким образом, что это делает его одинаковым во всем.
Различные типы слов, которые вы увидите, когда будете иметь дело с решениями, — это такие слова, как растворенный и платежеспособный.Растворение фактически растворяется в растворителе. Поэтому все, что растворяется, является растворенным веществом, а то, в чем оно растворяется, является растворителем. Универсальным растворителем, с которым вы столкнетесь, является вода, и это имеет смысл, поскольку большинство веществ растворяется в воде, но есть и другие типы решений, которые вы также увидите. Одним из них является газ, растворенный в газе, и вы думаете, вы думаете, что воздух, которым мы дышим, представляет собой смесь газов. Газ растворяется в жидкости, и яркий пример тому — пузырьки двуокиси углерода.Они на самом деле газообразные или растворены в жидкости газированной воды.
Тогда у нас есть жидкость, растворенная в жидкости. Сок является хорошим примером этого. немного свежевыжатого сока или что-то в этом роде. Вы можете растворить твердое вещество в жидкости, которая похожа на наш сахар. Наш сахар будет нашей твердой формой, растворенной в нашем жидком чае, которая будет нашей. Они действительно видят это на самом деле довольно часто, растворение твердого вещества в жидкости.
Твердое вещество растворяется в твердом веществе. Сталь или металлический сплав любого типа на самом деле представляет собой смесь твердых веществ.
Газ, растворенный в твердых веществах, таких как пена или зефир. Так что это разные типы смесей, которые вы увидите в разных средах, в которых они на самом деле, и есть разные слова, с которыми мы на самом деле тоже можем столкнуться. Растворимый против нерастворимый, и когда вы имеете дело с реакциями двойной замены, у вас будет осадок. Осадки нерастворимы, то есть выходят из раствора. Если что-то растворимо, это означает, что оно на самом деле растворяется в растворе, оно не выходит, оно все еще находится внутри раствора.
Вы можете увидеть слово смешиваемое и несмешиваемое. Это смешиваемое вещество может звучать как смешиваемое. Это именно то, что это значит. Если что-то смешивается, они на самом деле это то, что они могут смешать вместе. Если они несмешиваемы, как масло и вода, они фактически не могут смешиваться друг с другом. Итак, эти два, эти четыре слова вы можете увидеть довольно часто, когда имеете дело с типами решений.
,типов решений — учебный материал для IIT JEE

Мы знаем, что бинарный раствор представляет собой гомогенную смесь двух веществ: растворенного вещества и растворителя.
:
Растворенное вещество : растворенное вещество, присутствующее в меньшем количестве.
Растворитель : вещество, которое растворяет, присутствует в большом количестве.
Что является основой дифференциации решения? ИЛИ
Почему такое много типов решений?
Различные типы приведены ниже:
СЛУЧАЙ — 01: На основе воды как растворителя
Водный раствор: Растворы, содержащие воду в качестве растворителя .
Пр. .сахар в воде, углекислый газ в воде и т. д.
Неводный раствор: Растворы, содержащие растворитель, отличный от воды, такие как эфир, бензол, бензин, четыреххлористый углерод и т. Д.
отл. сера в сероуглероде, нафталин в бензоле и т. Д.
СЛУЧАЙ — 02: На основе количества растворенного вещества
Ненасыщенный раствор: Говорят, что раствор является ненасыщенным, когда растворитель (например, вода) способен растворять больше растворенного вещества (например,грамм. Сахар) при (определенной / фиксированной) температуре.
Пример: 1% раствор NaCl (1 г NaCl в 99 мл чистой воды)
Насыщенный раствор: Раствор считается насыщенным, когда растворитель не способен больше растворять растворенное вещество при (определенной / фиксированной) температуре.
Пример: 40% раствор NaCl
Пересыщенный раствор : Говорят, что раствор пересыщен, когда растворенное вещество присутствует в избыточном количестве и сильно растворяется при повышении температуры или давления.Они обычно кристаллизуются в основании методом, называемым кристаллизацией.
Пример: 70% раствор NaCl

СЛУЧАЙ — 03: На основе типа / состояния растворителя используется
(Растворители и растворители могут быть из любой формы вещества: твердого, жидкого или газообразного)
растворенного вещества | Растворитель | Пример |
Твердый | Жидкость | Минеральная вода, физиологический раствор (NaCl), сахарный раствор |
Твердый | Твердый | Сплавы типа латуни, представляющие собой раствор цинка в меди |
Жидкость | Твердый | Стоматологическая амальгама, ртуть в серебре |
Жидкость | Жидкость | Этиленгликоль в воде (антифриз в радиаторе), уксусная кислота в воде (уксус) |
Газ | Твердый | Газообразный водород в металлическом палладии |
Газ | Жидкость | Co 2 в воде (газированный напиток), раствор аммиака |
Газ | Газ | Воздух в атмосфере, может газы в азоте |
СЛУЧАЙ — 04: На основе количества добавленного растворителя
Концентрированный раствор : Говорят, что раствор концентрируется, когда в нем содержится большое количество растворенного вещества в данном растворителе.
Пример: Рассольный раствор, апельсиновый сок, чай темного цвета.
Разбавленный раствор : Говорят, что раствор является разбавленным, если он содержит небольшое количество растворенного вещества в большом количестве растворителя.
Пример: Солевой раствор, чай светлого цвета

CASE-05: на основе концентрации растворенного вещества в двух растворах
(Давайте рассмотрим систему, содержащую раствор в химическом стакане, и внутри этого раствора находится биологическая ячейка, в этой клетке содержится жидкость, все вместе у нас есть две жидкости в этой системе)
Изотонический раствор: Два раствора с одинаковой концентрацией растворенного вещества, поэтому вода движется через клеточную мембрану в обоих направлениях, сохраняя размер клетки.
Пример: Раствор 0,89% NaCl.
Гипертонический раствор: Раствор, хранящийся в химическом стакане, имеет более высокую концентрацию растворенного вещества, поэтому вода выходит из ячейки и попадает в раствор в химическом стакане , в результате чего клетка плазмолизируется / сжимается
Пример: Солевой раствор, кукурузный сироп
Гипотонический раствор : раствор, хранящийся в химическом стакане, имеет более низкую концентрацию растворенного вещества, поэтому вода попадает в ячейку , вызывая ее набухание и, наконец, взрыв.
Пример: Вода


Особенности курса
- 731 Видео Лекции
- Редакция Примечания
- Предыдущий год Документы
- Mind Map
- Планировщик исследования
- NCERT Solutions
- Дискуссионный форум
- Тестовая бумага с Video Solution
,
FAQ Типы решений и зарядка Модель
Как типы решений SAP CAL, перечисленные в ключевых понятиях в документации SAP CAL, относятся к модели начисления платы SAP CAL? Какие расходы мне придется заплатить за запуск решения?
В целом мы предлагаем три вида решений:
- Бесплатные решения с поддержкой сообщества, для которых требуется только учетная запись облачного провайдера
- Решения, которые полностью поддерживаются и работают с подпиской SAP CAL и лицензией на продукт Решения
- Модельной Компании, поставляемые с услугой Модельной Компании.
1. Бесплатные решения
Бесплатные решенияпоставляются со специальными условиями, которые ограничивают использование решения. Как правило, бесплатные решения не предлагаются для какой-либо цели, приносящей доход. Все бесплатные решения поставляются только с поддержкой сообщества. Это означает, что вы можете обсудить возможные проблемы здесь, вместо того, чтобы обращаться в службу поддержки SAP.
Следующие типы решений могут быть запущены бесплатно:
- Решения с бесплатным пробным периодом
- Издания для разработчиков
- Образовательные решения
Для запуска бесплатных решений вам не требуется пакет подписки на SAP CAL и лицензия на продукт, но вам все же нужна учетная запись у поставщика поддерживаемой инфраструктуры (Amazon Web Services, Microsoft Azure или Google Cloud Platform) за ваш счет.
Решения с бесплатным пробным периодом 
Продолжительность использования
Эти решения можно использовать бесплатно в течение 30 дней. Экземпляр, запущенный как пробный, можно продолжить в режиме подписки, самое позднее через 30 дней. В противном случае пробное решение будет приостановлено.
Описание
Пробное решениепредназначено для самообучения, для практического опыта, для первых шагов, если вы хотите убедиться, что решение обеспечивает ожидаемую от него выгоду.
В течение пробного периода решение может быть изменено на решение с подпиской с помощью функции разблокировки. Вам нужна лицензия продукта для решений и пакет подписки SAP CAL, который доступен в магазине SAP. Проверка обоих выполняется в SAP CAL, как только вы выбираете разблокировать .
Условия использования
В соответствии с условиями решения в испытательный срок не должны использоваться для:
- Разработка, создание прототипа или подтверждение концепции
- Проведение учебного курса или семинара с сотрудниками, партнерами или клиентами
- Применение коммерческих лицензионных ключей или загрузка данных для производственного использования в пробные системы
- Демонстрация программного обеспечения для потенциальных клиентов
- Сравнительный анализ с конкурирующими продуктами третьих сторон
Пример условий и положений пробной версии можно найти здесь. Лицензионное соглашение.
Developer Edition 
Продолжительность использования
ВыпускиDeveloper Edition могут быть запущены без ограничения по времени их использования.
Описание
Эти решения поставляются с одним, иногда с двумя пользователями, которые зарегистрированы как разработчики. Целью этого предложения является поддержка вашего самообразования.
См. Также: Как запросить и установить лицензионные ключи Minisap
Условия использования
В соответствии с положениями и условиями редакции разработчика не могут быть использованы для каких-либо целей, не связанных с разработкой.В разделе 3 условий и положений для разработчиков кратко изложены ограничения, применимые к использованию редакции dev.
Положения и условия разработчика прилагаются к данной статье SCN.
Developer Edition не могут быть продолжены в качестве решения по подписке в настоящее время. В настоящее время мы работаем над законодательной базой, чтобы позволить это.
SAP DEVELOPER CENTER — ЛИЦЕНЗИОННОЕ СОГЛАШЕНИЕ ДЛЯ РАЗРАБОТЧИКА ПРОГРАММНОГО ОБЕСПЕЧЕНИЯ MASTER
образовательных решений 
Продолжительность использования
Эти решения можно использовать бесплатно в течение периода, указанного в прилагаемом документе «Условия и положения» (обычно в течение 90 дней).В отличие от решения с пробным периодом, экземпляр не может быть продолжен в режиме подписки. Образовательные решения часто являются частью учебного курса openSAP или содержат контент, который мы не хотели бы предлагать в нашей модели подписки.
Описание
Образовательные решениячасто являются частью учебного курса openSAP или содержат контент, который мы не хотели бы предлагать в нашей модели подписки.
Условия использования
Применяются условия бесплатного пробного периода.
2. Решения с подпиской SAP CAL
Продолжительность использования
Нет ограничений для этих решений в SAP CAL; после развертывания экземпляра решения в режиме подписки вы можете запускать его, если действующая лицензия на продукт, примененная к системе, действительна и при условии использования подписки SAP CAL. Для приобретения пакетов подписки на библиотеку SAP Cloud Appliance посетите SAP Store или обратитесь к руководителю своего аккаунта.
Описание
Также нет ограничений относительно сценариев использования решения. Использование определяется типом лицензионного ключа, который вы применяете к системе.
Большинство решений можно использовать в пробном режиме, прежде чем разблокировать их, чтобы продолжить с подпиской. Разблокировка может быть сделана в любое время в течение пробного периода. Конечно, решение может быть запущено в режиме подписки с самого начала.
Смотри также:
Как запросить и установить лицензионные ключи продукта для решений SAP
Мы предоставляем поддержку продуктов SAP для решений, работающих с лицензией на продукт в соответствии с сертификацией corre
.Пример ненасыщенных растворов :
Возьмите сахар и воду в контейнер. Когда к сахару добавляют воду, она полностью растворяется. Полное растворение сахара в воде называется растворением. Этот вид растворения происходит, когда к сахару добавляют воду, потому что здесь точка насыщения не достигнута, и, пока сахар растворяется, раствор считается ненасыщенным.Но когда раствор достигает точки насыщения, даже если сахар добавляется дальше, сахар больше не растворяется в воде. То же самое происходит с солью и водой. Поскольку соль полностью растворяется в воде, полученный раствор называется ненасыщенным раствором. Несколько других примеров, таких как порошки сока и порошки чая, при смешивании с водой и порошкообразный белок, смешанный с молоком, полностью растворяются, образуя ненасыщенный раствор.Факты о ненасыщенном растворе :
Свойства ненасыщенных растворов :
Факторы, влияющие на насыщение :
С ростом температуры растворимость ионных растворов возрастает с ожиданием соединений, содержащих анионы.
Для достижения большей растворимости твердые частицы должны быть тонко разделены. Концентрация на поверхности растворенного вещества приводит к более высокой кристаллизации в неподвижном растворе, поэтому путем максимизации чистой скорости растворения перемешивание раствора предотвращает накопление. температура, скорость кристаллизации будет зависеть от концентрации растворенного вещества на поверхности кристалла в отличие от скорости растворимости. Раствор будет насыщенным, и динамическое равновесие может быть достигнуто, если растворимость и скорости кристаллизации одинаковы.Скорость растворения минус скорость кристаллизации определяется как суммарная скорость растворения. Считается, что соединения, которые содержат двойные связи, являются ненасыщенными органическими соединениями, а соединения, которые не содержат множественных связей, называются насыщенными органическими соединениями. Насыщенные молекулы имеют как сигма-, так и пи-связь, и, таким образом, из-за присутствия пи-связи происходит ненасыщенность. Обычно в олефинах с двойной связью, ацетиленах с тройными связями и циклических молекулах происходит ненасыщенность. В присутствии катализаторов ненасыщенные соединения смогут реагировать с водородом.Насыщение показано с наличием одинарной связи в молекуле, тогда как ненасыщенность вводится присутствием множества связей, и степень ненасыщенности покажет количество P-связей.
Пример: В этане (C2H6), который попадает под алканы, содержится только сигма-связь, и это показано ниже:
Он насыщен и содержит семь одинарных сигма-связей с молекулярной формулой C2H6.
В этане (C2h5) наличие одной двойной связи и четырех сигма-связей может быть показано структурой этана, которая представлена ниже.
Поскольку каждая двойная связь имеет одну пиг-связь и одну сигма-связь, присутствие даже одной пиг-связи сделает молекулу этана ненасыщенной. Они имеют различную форму, они могут образовывать разветвленные цепи или прямые цепи или кольца. Алкены, имеющие разные формы, называются изомерами, но имеют одинаковые атомы. Большие алкены имеют более низкие температуры плавления и кипения, где меньшие алкены имеют высокие температуры плавления и кипения, и поэтому при комнатной температуре они являются газообразными по своей природе.
В этине (C2h3), который попадает под алкины, он содержит одну тройную связь и две одинарные связи. Ниже изображено:
Этин-тройная связь имеет одну сигма-связь и две пи-связи, и, таким образом, это представляет ненасыщенность. Поскольку в алкинах присутствуют две пи-связи, это приводит к двум степеням ненасыщенности. Их также называют ацетиленом, и они могут образовывать разветвленные или прямые цепи, и они редко встречаются в форме кольца. Число атомов водорода уменьшается на два, когда каждая новая пи-связь вводится в молекулу.В циклических молекулах, таких как циклопропан, его химическая формула является C3H6, которая похожа на формулу пропена C3H6. Здесь нет связи и поэтому она вводится с ненасыщенностью в один градус.
Ниже представлены соответственно циклопропан и пропен, которые схожи по структуре:
Формула для расчета степени ненасыщенности : Для молекулы степень ненасыщенности можно рассчитать по формуле, приведенной ниже: Степень ненасыщенности = количество полных двойных связей + (2 × количество полных тройных связей) + (общее количество колец)Когда речь идет об изомерах, имеющих одинаковую молекулярную формулу, будет иметь одинаковую степень ненасыщенности изомеров конкретной молекулы.В этом случае степень ненасыщенности можно рассчитать по формуле: Степень ненасыщенности = [2 + {2 × количество молекул углерода} + количество молекул азота — количество молекул водорода — количество молекул галогена] / 2As на формулу, этан имеет одну степень ненасыщенности. Потому что здесь число молекул углерода = 3, а количество молекул водорода = 6, поэтому [2 + {2 ×} — 6] / 2 = 1 — степень ненасыщенности. Ненасыщенные углеводороды : Ненасыщенные углеводороды — это алифатические углеводороды, в которых между атомами углерода имеется двойная или тройная связь.Из-за не полностью заполненной валентности углерода они называются ненасыщенными.
Чтобы получить насыщенные молекулы, они могут подвергнуться реакции присоединения с атомами или группами. В алкенах и алкинах атом углерода sp2 / sp гибридизован. Структура алкина линейна, а структура алкена тригональна. Примерами ненасыщенных углеводородов являются ацетилен, этилен, изобутен и т. Д.
,


