Свойства песка: механические, химические и лечебные
Один из самых удивительных материалов на планете – это песок. Свойства песка, несмотря на его кажущуюся простоту, достаточно интересны и практически ни одно другое вещество в мире не может показать ничего аналогичного ему.
Равномерность высыпания
Ничто не высыпается так же равномерно, как песок. Свойства песка позволяют данному материалу всегда сыпаться из одинакового отверстия с абсолютно неизменной скоростью. Именно поэтому он был взят в качестве основного элемента для работы часов. Существовали и другие вариации, работающие на воде и других материалах, но только песочные часы всегда неизменно верно показывали точное время. В качестве примера можно представить воронку, в которую насыпали, допустим, килограмм песка. Можно засечь время, пока он высыплется и попробовать теперь насыпать туда же не один килограмм, а тонну. Скорость движение не возрастет, несмотря на значительное увеличение давления. Разумеется, для этого требуется, чтобы песок был однородным и хотя бы сравнительно одинаковым, но он в большинстве случаев не слишком сильно отличается.
Проницаемость для воды
Возможность пропускать воду – это еще одно полезное механическое свойство песка. Песок, что характерно, состоит из мелких частиц, между которыми остается достаточно свободного места, чтобы вода могла просачиваться. Чем больше размер песчаных «кусочков», тем выше скорость течения жидкости. Интересен в данном случае тот факт, что одновременно с пропусканием воды, песок умудряется удерживать все остальные примеси и тем самым выполняет работу фильтра. Фактически все изделия для очистки жидкости работают именно по такой схеме. В то же время чем больше песок находится без движения, тем сильнее он слеживается и постепенно теряет это свойство.
Песок не сжимается
Невозможно сжать песок. Свойства песка таковы, что он всегда сохраняет одну и ту же форму. Разумеется, как уже было сказано, он слеживается и частично теряет в объеме, но это естественный процесс, который со временем завершается, и вот после этого сжать песок уже будет нереально. Отдельно можно сказать о другом механическом свойстве, логично выходящем из этого. Песок распределяет все принимаемое давление равномерно во все стороны. Например, если взять песок и насыпать его в любую банку, то при последующем давлении он будет передавать его не только на дно, но и на стенки. Данное механическое свойство песка часто используется строителями. Такое качество делает его универсальным.
Отдельно можно сказать о другом механическом свойстве, логично выходящем из этого. Песок распределяет все принимаемое давление равномерно во все стороны. Например, если взять песок и насыпать его в любую банку, то при последующем давлении он будет передавать его не только на дно, но и на стенки. Данное механическое свойство песка часто используется строителями. Такое качество делает его универсальным.
Химические свойства песка
К ним можно отнести устойчивость данного материала к большинству видов внешнего агрессивного воздействия.
- Кислотоупорность. Песок достаточно инертно относится к воздействию кислот, щелочей и других подобных веществ. Именно поэтому его используют для создания специальных видов бетона, способных противостоять такому разрушительному влиянию. В свою очередь, этот строительный материал применяется в промышленном производстве и в любых других случаях, когда от постройки требуется максимальное сопротивление всему, чему угодно.
- Огнеупорность.
 Вплоть до температуры +550 градусов по Цельсию он никак не изменяется. О том, какие свойства песка проявляются выше данного показателя, могут сказать стеклодувы, так как именно этот материал применяется для создания любых стекол.
Вплоть до температуры +550 градусов по Цельсию он никак не изменяется. О том, какие свойства песка проявляются выше данного показателя, могут сказать стеклодувы, так как именно этот материал применяется для создания любых стекол. - Морозоустойчивость. Вещество очень хорошо показывает себя при низких температурах. Свойства его не изменяются. Примером применения в морозы можно считать посыпание песком тротуаров и дорог. Этот материал при таком варианте использования обеспечивает более качественное сцепление обуви пешеходов или колес автомобилей с поверхностью, помогая избегать травм и аварий.
В зависимости от вида песка, от его происхождения, он может обладать и другими удивительными химическими свойствами. Например, существует так называемый поющий песок, который начинает издавать странные звуки, если его потревожить. Это буквально мистическая особенность, с которой современная наука пока не может разобраться, ведь тот же самый песок в лабораторных условиях не звучит и по составу ничем не отличается от других аналогов.
Лечебные свойства
С точки зрения медицины, основное свойство песка заключается в равномерном нагреве и острых гранях. О таких особенностях этого материала было известно еще до нашей эры, однако лишь в 1889 году врачом Парийским Н. В. была собрана научная база и доказательства, позволившие внедрить лечение песком в качестве вспомогательных процедур.
Смысл заключается в том, что после нагрева песок будет отдавать тепло с одинаковой интенсивностью на протяжении долгого времени, что позволяет равномерно прогревать больное место (особенно актуально для борьбы с заболеваниями суставов). В то же время песок сам по себе обладает сравнительно ребристой поверхностью, что дополнительно обеспечивает легкий микро-массаж, воспроизвести который другими методами практически невозможно.
Итог
Песок активно используется в большинстве сфер деятельности человека. Он лечит, спасает, является составной частью большинства строительных материалов и при этом он очень дешевый. Песка на планете много и его количество постоянно растет, ведь он является результатом разрушения горных массивов, а этот процесс постоянен, и остановить его невозможно. Несколько лет назад появлялись идеи создания даже двигателей на основе этого вещества, и результаты были поразительными. КПД составлял практически 100% и единственной проблемой стал быстрый износ деталей, с которым современная наука пока не может справиться.
Песка на планете много и его количество постоянно растет, ведь он является результатом разрушения горных массивов, а этот процесс постоянен, и остановить его невозможно. Несколько лет назад появлялись идеи создания даже двигателей на основе этого вещества, и результаты были поразительными. КПД составлял практически 100% и единственной проблемой стал быстрый износ деталей, с которым современная наука пока не может справиться.
Химический состав стекла ― Стекольная Компания
В стекловарении используют только самые чистые разновидности кварцевого песка, в которых общее количество загрязнений не превышает 2—3 %. Особенно нежелательно присутствие железа, которое даже в ничтожных количествах (десятые доли %) окрашивает стекло в зеленоватый цвет. Если к песку добавить соду Na2CO3, то удается сварить стекло при более низкой температуре (на 200—300°С). Такой расплав будет иметь менее вязкий (пузырьки легче удаляются при варке, а изделия легче формуются). Но! Такое стекло растворимо в воде, а изделия из него подвергаются разрушению под влиянием атмосферных воздействий. Для придания стеклу нерастворимости в воде в него вводят третий компонент — известь, известняк, мел. Все они характеризуются одной и той же химической формулой — СаСО3
Для придания стеклу нерастворимости в воде в него вводят третий компонент — известь, известняк, мел. Все они характеризуются одной и той же химической формулой — СаСО3
Стекло, исходными компонентами шихты которого является кварцевый песок, сода и известь, называют натрий-кальциевым. Оно составляет около 90 % получаемого в мире стекла. При варке карбонат натрия и карбонат кальция разлагаются в соответствии с уравнениями:
Na2CO3 = Na2O + CO2
СаСО3 = СаО + СО2
В результате в состав стекла входят оксиды SiO2, Na2O и СаО. Они образуют сложные соединения — силикаты, которые являются натриевыми и кальциевыми солями кремниевой кислоты.
В стекло вместо Na2O с успехом можно вводить К2О, а СаО может быть заменен MgO, PbO, ZnO, BaO. Часть кремнезема можно заменить на оксид бора или оксид фосфора (введением соединений борной или фосфорной кислот). В каждом стекле содержится немного глинозема Аl Иногда его добавляют специально. Каждый из перечисленных оксидов обеспечивает стеклу специфические свойства. Поэтому, варьируя этими оксидами и их количеством, получают стекла с заданными свойствами. Например, оксид борной кислоты В2О3 приводит к понижению коэффициента теплового расширения стекла, а значит, делает его более устойчивым к резким температурным изменениям. Свинец сильно увеличивает показатель преломления стекла. Оксиды щелочных металлов увеличивают растворимость стекла в воде, поэтому для химической посуды используют стекло с малым их содержанием.
Иногда его добавляют специально. Каждый из перечисленных оксидов обеспечивает стеклу специфические свойства. Поэтому, варьируя этими оксидами и их количеством, получают стекла с заданными свойствами. Например, оксид борной кислоты В2О3 приводит к понижению коэффициента теплового расширения стекла, а значит, делает его более устойчивым к резким температурным изменениям. Свинец сильно увеличивает показатель преломления стекла. Оксиды щелочных металлов увеличивают растворимость стекла в воде, поэтому для химической посуды используют стекло с малым их содержанием.
Способы очистки воды
Для того, чтобы очистить воду в городской квартире, не обязательно отдавать ее на анализ в лабораторию. Состав важен, однако «букет» водопроводной воды, как правило, предсказуем: предельные значения уровня вредных веществ не превышены, соответствие СанПиН соблюдено. Но пить воду прямо из крана мы вам все же не советуем: вредные вещества, хоть и в небольших концентрациях, там присутствуют и в долгосрочной перспективе могут обернуться головной болью.
Но пить воду прямо из крана мы вам все же не советуем: вредные вещества, хоть и в небольших концентрациях, там присутствуют и в долгосрочной перспективе могут обернуться головной болью.
Фильтрация — это комплексный процесс, сочетающий в себе несколько способов очистки. Познакомимся с основными из них.
Механическая (предварительная) фильтрация
Самый простой способ очистки воды: она проходит через своеобразное «сито», и все частицы крупнее его ячеек задерживаются. Один из самых распространенных материалов для картриджей механической фильтрации — полипропилен: химически инертный, безвредный и бюджетный материал, поры которого можно «подогнать» под разный (так или иначе достаточно крупный) диаметр.
Механическая фильтрация активно используется на городских водоканалах, особенно при заборе воды из открытых источников — рек, озер, водохранилищ. Вода очищается от песка, глины, растений и прочих нежелательных «добавок». Вот только поры фильтрующего материала достаточно велики, и растворенные загрязнители (активный хлор, нитраты и т.
Это не значит, что эти «другие» более продвинутые: просто у предфильтров и фильтров тонкой очистки разные цели. Механическая фильтрация, например, позволяет быстро и без удара по карману очистить воду от механических и видимых глазу примесей во всей квартире или даже во всем доме — но с растворенными вредными веществами этот номер не пройдет. Впрочем, обо всем по порядку.
Сорбция
Если механический фильтр — это сито, то сорбционный — это губка, которая впитывает растворенные в воде примеси. По такому же принципу работают противогазы — только загрязнители они извлекают не из жидкости, а из воздуха. Впитывающие материалы называют сорбентами, самый популярный из них — активированный уголь.
Что значит активированный?
Сырье (в случае АКВАФОР это кокосовая скорлупа) превращают в уголь, нагревая без доступа кислорода — этот процесс называется «пиролиз». Полученный уголь обрабатывают водяным паром при температуре около 1000°C. В результате получается очень чистый материал с отличными сорбционными качествами: площадь поверхности составляет около 1000–1500 квадратных метров на 1 грамм угля.
Полученный уголь обрабатывают водяным паром при температуре около 1000°C. В результате получается очень чистый материал с отличными сорбционными качествами: площадь поверхности составляет около 1000–1500 квадратных метров на 1 грамм угля.
Еще одна небольшая деталь: не любой активированный уголь позволяет хорошо очистить воду. Значение имеет и размер гранул, и его происхождение: березовый, а тем более каменный уголь по качеству не сравнятся с кокосовым. Он лучше активируется, и получаемая площадь поверхности во много раз превосходит все ожидания от угля другого типа.
Современные фильтрующие смеси содержат не только уголь, но и дополнительные сорбенты, которые придают материалам синергетический эффект. В качестве такого элемента АКВАФОР использует микроволокно AКВАЛЕН™: это не только «ловушка» для тяжелых металлов, но и гидрофильный («любящий воду») агент, который позволяет использовать мельчайшие гранулы угля, а значит увеличивать площадь контакта с водой и глубину очистки.
Ионный обмен
В водоочистке это процесс, при котором ионы кальция и магния (солей жесткости, содержание которых определяет мягкость или жесткость воды) замещаются ионами натрия — то есть вода становится мягкой. Как правило, для этого применяют ионообменные смолы. В умягчителях они действуют сами по себе, выполняя свою основную функцию — умягчение, — а в сорбционных фильтрах сочетаются в тех или иных пропорциях с активированным углем и прочими фильтрующими средами.
Одно из главных и весьма полезных свойств ионообменных смол — это способность к регенерации: смолу можно «воскресить» обычной поваренной солью.
Ионообменные материалы (иониты) также для служат для очистки от тяжелых металлов — например, свинца. Но их эффективность в этом не так уж впечатляет, поскольку отсутствует селективность (избирательность): допустим, что на тысячу ионов кальция приходится один ион свинца, и в условиях такого количественного превосходства свинец чаще всего «проскользнет незамеченным». Чтобы исправить возможные недочеты, специалисты АКВАФОР разработали особое ионообменное микроволокно АКВАЛЕНТМ, которое «специализируется» именно на тяжелых металлах.
Чтобы исправить возможные недочеты, специалисты АКВАФОР разработали особое ионообменное микроволокно АКВАЛЕНТМ, которое «специализируется» именно на тяжелых металлах.
Человеческий организм не «оборудован» никакими защитными «противометаллическими» механизмами, и, скажем, мышьяк, ртуть и прочие незваные гости там просто накапливаются, приводя к непрогнозируемым последствиям — скорее всего, неприятным.
Полое волокно
Продвинутая технология мембранной очистки, отсеивающая мельчайшие примеси, включая бактерии и цисты (микрофильтрационная мембрана с порами до 0,1 мкм), а в некоторых случаях и вирусы (ультрафильтрационная мембрана с порами до 0,01 мкм, — поскольку вирусы относятся к самым мелким из возможных примесей).
Да, полое волокно это тоже мембрана: в фильтре ее можно расположить и в виде рулона, как в случае обратноосмотической, но для удобства и минимизации занимаемого пространства из нее делают тонкие «ниточки», стенки которых состоят из супермелких полых ячеек, через которые как раз и пытаются вместе с потоком воды пройти загрязнители — впрочем, безуспешно.
Обратный осмос
Очистка происходит за счет обратноосмотической мембраны, которая разделяет поток на чистую и дренажную воду. Никакие примеси — ни растворенные, ни нерастворенные — она не пропускает, и на сегодняшний день это самый эффективный способ фильтрации.
Перед обратноосмотической мембраной обязательно должны быть установлены предфильтрационные модули, чтобы избежать ее повреждения. А еще вода после очистки обратным осмосом требует минерализации, поскольку полезные минералы удаляются мембраной так же эффективно, как и вредные вещества.
Современные обратноосмотические системы прошли многочисленные этапы технологической «эволюции», стали менее дорогостоящими и занимают меньше места: не всем из них даже требуется отдельный накопительный бак.
Линейка современных обратноосмотических систем АКВАФОР DWM обеспечивает максимально возможную в домашних условиях степень очистки: в сравнении с традиционными системами у них более высокая скорость фильтрации, небольшие габариты и оптимальное соотношение чистой воды и дренажа — его намного меньше, чем в стандартных системах.
Сейчас качество жизни и здоровье напрямую зависят от интеграции технологий в жизнь. Так пусть это будут самые лучшие технологии, которые фундаментально меняют мир к лучшему. Выбирайте себя и своих близких — а АКВАФОР вас в этом поддержит.
Про сахара с точки зрения химика. Химия на кухне 2 / Хабр
Старинная форма фасовки сахара — «сахарная голова»
Выкладываю продолжение, как обещал. Первый пост был про соль.
Про сахар. Какие бывают сахара. Про кленовый сахар и сахар ли он? Сосульки из кленового сока — ценный дар природы. Моно- и много- сахариды. Что общего у омара, тарантула, ёлки, гриба, мёда и ракеты «Кассам». Ставим химический опыт по превращению крахмала… Как блеснуть эрудицией. Фруктоза — польза и вред, две стороны вопроса. Кто виноват в том, что от молока болит живот. Как получается, что кислое варенье меньше засахаривается. Из чего делают мёд. Из чего делают сахар. Про тростниковый сахар — едим ради его вкуса.
Всем привет! Что-то после рассказов про «белую смерть», захотелось поговорить про «сладкую». Это такой каламбур, шутка юмора. Вопрос вреда, и в данном случае, как Вы уже догадываетесь, заключается в основном, в неумеренном потреблении. Ну вот, значит, встречаются на полке много разных сортов сахара, и из местных и приезжие, и начинают выяснять, кто из них лучше… Стоп! Не допустим мордобоя, и разберемся сами.
Это такой каламбур, шутка юмора. Вопрос вреда, и в данном случае, как Вы уже догадываетесь, заключается в основном, в неумеренном потреблении. Ну вот, значит, встречаются на полке много разных сортов сахара, и из местных и приезжие, и начинают выяснять, кто из них лучше… Стоп! Не допустим мордобоя, и разберемся сами.
Сироп из кленового сока
Вот и начнем разбор полётов с него, потому что, его мало и штука это интересная. Это традиционный продукт, который получали в США и Канаде, в то время, когда сахара свекловичного еще не было, а тростниковый был дорог. Получают его упариванием весеннего кленового сока. Кстати, наверное Вы знаете, что так же как из берёзы, весной, можно добывать сок и из клёна, и не обязательно в Америке. Во время моего проживания в подмосковном Троицке, случилась такая весна, что морозец еще держался, а в деревьях сок уже двинулся. В результате из всех трещинок и поломов на веточках начали расти сосульки.
Реально вкусные сосульки
Вычислив природу образования этих странно высоко висящих сосулек — попробовал их на вкус… в общем первый сок с любого дерева сладенький, отдает древесиной, некоторые породы деревьев давали совсем вкусный, некоторые — с неприятным привкусом, но сладкий. Так что в кленовом сахаре нет ничего удивительного, зато есть довольно много минеральных веществ, и сладость его определяется… Оп!
Так что в кленовом сахаре нет ничего удивительного, зато есть довольно много минеральных веществ, и сладость его определяется… Оп!
Да ведь получается, что это и не сахар вовсе, а лишь его близкий химический родственник — глюкоза. Она получается в дереве при расщеплении накопленного осенью крахмала. Вот так, легко и естественно, мы пришли к теме моно-, ди-, и полисахаридов. Постараюсь внести ясность. Сахара — это целый класс соединений, их еще зовут — углеводы. На самом деле какая-то смысловая разница между ними есть, расплывчатая, но нас сильно стыдить за её незнание вряд ли будут. Вообще, растительное царство, оказывается, в основном, состоит из разнообразнейших углеводов или по-другому поли-, олиго-, три-, ди- и моносахаридов. При этом некоторые из них бывают сладкими… Удивил?
Итак: что вообще, в химии, значит сахара или углеводы? Ну их так назвали потому что, в начале развития химии, их анализ показывал, что они как бы состоят из смеси молекул воды и углерода. Тогда еще не вникали в тонкости структуры молекулы — то есть, как атомы соединены между собой. А это важно. Анализ, чаще всего, выполнялся самым простым способом — сжиганием и взвешиванием. После сжигания становилось известно количество углерода, водорода и кислорода, содержавшегося в навеске вещества. А сахарами — понятно — под рукой был сахар, и вещи химически похожие на него, стали называть (моно, ди… поли-) — сахаридами или углеводами. Самые простые молекулы сахаров, которые уже не удавалось расщепить кипячением в воде с кислотой, назвали моносахаридами, — сахара, одна молекула которых расщеплялась на две молекулы моносахаридов — назвали дисахаридами. Олигосахариды, это сахара состоящие из небольшого количества моносахаридов. В этом месте каждый сам придумывает ему приятную шутку про олигархов и олигосахариды. Напрашивается. Полисахариды — это разнообразнейшие природные полимеры из моносахаридов.
Тогда еще не вникали в тонкости структуры молекулы — то есть, как атомы соединены между собой. А это важно. Анализ, чаще всего, выполнялся самым простым способом — сжиганием и взвешиванием. После сжигания становилось известно количество углерода, водорода и кислорода, содержавшегося в навеске вещества. А сахарами — понятно — под рукой был сахар, и вещи химически похожие на него, стали называть (моно, ди… поли-) — сахаридами или углеводами. Самые простые молекулы сахаров, которые уже не удавалось расщепить кипячением в воде с кислотой, назвали моносахаридами, — сахара, одна молекула которых расщеплялась на две молекулы моносахаридов — назвали дисахаридами. Олигосахариды, это сахара состоящие из небольшого количества моносахаридов. В этом месте каждый сам придумывает ему приятную шутку про олигархов и олигосахариды. Напрашивается. Полисахариды — это разнообразнейшие природные полимеры из моносахаридов.
Вы удивитесь, но панцирь краба, шкурка тарантула и основное вещество грибов, состоят из полисахарида — хитина. Ах, какой соблазн — начать производство — «крабового сахара». Или «скорпионового», да хоть «грибного». Или даже водки. Нет! Не получается. Моносахарид из хитина хоть и не сладкий, а очень интересный. Это глюкозамин — популярное средство при болях в суставах. Хотя официальная медицина и эксперименты показывают, что плацебо почти так же хорошо действует. Только вот, если уж очень болит, тогда был замечен положительный эффект. Хотя, многие люди клянутся, что им реально помогает. Это вещество можно делать из шкурок от креветок. А вот если из этого хитина сделать трисахарид — хитозан, получится средство для похудения и перспективное средство для заживления ран. Мощный полисахарид — целлюлоза (она состоит из глюкозы, кстати), из неё гм… делают деревья, бумагу, хлопок и бездымный порох. Первый искусственный пластик был из нитроцеллюлозы и делали из него шары для бильярда и клавиши для роялей. До этого приходилось использовать слоновую кость.
Ах, какой соблазн — начать производство — «крабового сахара». Или «скорпионового», да хоть «грибного». Или даже водки. Нет! Не получается. Моносахарид из хитина хоть и не сладкий, а очень интересный. Это глюкозамин — популярное средство при болях в суставах. Хотя официальная медицина и эксперименты показывают, что плацебо почти так же хорошо действует. Только вот, если уж очень болит, тогда был замечен положительный эффект. Хотя, многие люди клянутся, что им реально помогает. Это вещество можно делать из шкурок от креветок. А вот если из этого хитина сделать трисахарид — хитозан, получится средство для похудения и перспективное средство для заживления ран. Мощный полисахарид — целлюлоза (она состоит из глюкозы, кстати), из неё гм… делают деревья, бумагу, хлопок и бездымный порох. Первый искусственный пластик был из нитроцеллюлозы и делали из него шары для бильярда и клавиши для роялей. До этого приходилось использовать слоновую кость.
Пектин — тоже полисахарид, природный, его много в яблоках и цитрусовых( и не только). Моносахарид, из которого он состоит, штука нам не слишком знакомая и сказать про неё что-либо интересное не могу, а грузить Вас ненужным не буду. Прелесть пектина, в том, что его легко и приятно извлекать из жмыха от выжимок сока. В общем, сырья навалом. Причем это не какая-то синтетика, вполне себе натуральный продукт. Старинный мармелад и зефир — обязаны были своему происхождению именно яблокам, вернее их пектину. В старинный зефир, видимо, добавляли просто разваренный яблочный жмых — ну или не сильно очищенный, даже вроде опилки от яблочных семянок попадались, поэтому он был сероватый и имел интересный такой, натуральный вкус. Там, в составе, яблоки фигурируют или яблочный пектин. Не помню.
Моносахарид, из которого он состоит, штука нам не слишком знакомая и сказать про неё что-либо интересное не могу, а грузить Вас ненужным не буду. Прелесть пектина, в том, что его легко и приятно извлекать из жмыха от выжимок сока. В общем, сырья навалом. Причем это не какая-то синтетика, вполне себе натуральный продукт. Старинный мармелад и зефир — обязаны были своему происхождению именно яблокам, вернее их пектину. В старинный зефир, видимо, добавляли просто разваренный яблочный жмых — ну или не сильно очищенный, даже вроде опилки от яблочных семянок попадались, поэтому он был сероватый и имел интересный такой, натуральный вкус. Там, в составе, яблоки фигурируют или яблочный пектин. Не помню.
Похоже на яблочный мармелад времён моей юности
А яблочный мармелад обходился естественным пектином, получавшимся из яблок при варке. Пектин — почти не усваивается организмом, зато хорошо соединяется с ионами тяжёлых металлов и радионуклидов(что то же самое, он радиацию не чувствует, он чувствует тяжелый металл. Химия) — это используют в медицине. Неплохое свойство для пищевой добавки, блокировать ядовитые тяжёлые металлы(многие из тяжелых металлов — ядовиты).
Химия) — это используют в медицине. Неплохое свойство для пищевой добавки, блокировать ядовитые тяжёлые металлы(многие из тяжелых металлов — ядовиты).
Поперечное сечение гликогена. В середине — белок. Вокруг — шуба из глюкозных частиц.
А вот еще полисахарид — гликоген, — основной запасной углевод человека и животных. Он откладывается в мускулах и печени. В отличие от запаса энергии накопленного в жирах, гликоген расщепляется быстро, но и запасы его невелики. Это запас энергии для относительно коротких по времени нагрузок.
Ну и распространённый углевод — крахмал. Из углеводов, до сих пор, именно его, мы съедаем больше всего. Моносахарид из которого построен крахмал — глюкоза. Потому и едим.
Вот так химики рисуют молекулы гликогена и крахмала
Внимание, опыт! Предлагаю химический опыт для домашней работы. Делать натощак. Чем голоднее будете, тем выше активность фермента амилаза в Вашей слюне. Берёте кусочек хлеба, чёрного, несладкого и жуёте. Долго. По мере жевания, Вы увидите, что хлеб становится слаще и слаще. Крахмал в хлебе, под действием фермента амилаза, превращается в сладкую мальтозу(глюкозу). Вот так лаборатория!
Долго. По мере жевания, Вы увидите, что хлеб становится слаще и слаще. Крахмал в хлебе, под действием фермента амилаза, превращается в сладкую мальтозу(глюкозу). Вот так лаборатория!
А ещё, если нагреть крахмал(до соответствующей температуры), то он станет «модифицированным» или по-старинному «декстрином». Просто станет лучше растворяться, даже в холодной воде. Не путать с ГМ! Потому повара часто прожаривают муку для приготовления соуса — она разойдётся в тёплой воде, и не будет комочков при приготовлении соуса. Можете сделать соус бешамель, и считать это домашней работой — рецепт взять из Интернета.
Мука, превращается, превращается в элегантный соус
В заголовке обещал упомянуть арабскую народную ракету «Кассам», к сахару она имеет то отношение, что её топливо состоит из смеси сахара и удобрения — селитры. Очень бюджетный вариант. Любители домашнего малобюджетного ракетостроения тоже очень уважают смесь из расплавленного сахара с селитрой, по причине сравнительной безопасности, удобства работы с ней и доступности.
Так что родственников у нашего сахара много — как у китайца с фамилией Ванг. Мы пробежались по всему этому богатству. Просто чтоб было интересно.
А сейчас, внимание! Штука, которую надо знать, чтобы прослыть тонким знатоком химии: — углеводы, это всё состоящее из сахаров и крахмала (обычно так говорят о том что едят, но как мы видели, это не совсем так — панцирь омара сожрать трудно, а усвоить ещё труднее). Углеводороды — это всё воняющее бензином и горючее, даже газ. Это едят в единственном случае — детский вазелин при запорах. Да и то, потому что, он как вошел, так и вышел, ну никак не усваивается. Запомнить просто — (угле-)водород — газ, его не съешь, (угле-)вод — вода, её можно выпить, а значит, съедобно. Теперь Вы можете блеснуть эрудицией на любой тусовке. И при переводах.
Так. Мы выяснили, что сахаров этих и моно и других, очень много. Не драматизируем. В реальной жизни нас волнует совсем немногие из них. О них поговорим. Моносахариды глюкоза и фруктоза употребляются нами в чистом виде и даже легко усваиваются.
Глюкоза усваивается моментально. Собственно она разносится кровью по нашему организму, для получения энергии, как топливо.
Фруктоза — в чистом виде этот моносахарид начали производить относительно недавно, лет 30-50 назад. До этого, его добывали в чистом виде, кажется, из клубней гладиолуса. Отделять фруктозу от глюкозы, например из мёда — не умели. А потому была она лекарством. Фруктоза считалась хорошим заменителем сахара — она в полтора раза слаще его, значит принесёт меньше калорий, она не повышает уровень сахара в крови, она не так быстро всасывается, как глюкоза, значит не будет сразу откладываться в жир. Она меньше вредит зубам, чем сахар, потому что хуже усваивается микробами. Теперь, когда фруктозу научились делать дёшево и много из сахара, стали выясняться и другие факторы. Выяснилось, что хоть она и слаще, люди используют не меньше фруктозы, а пьют более сладкое. Ещё — глюкоза моментально попадает в кровь и в нас начинает работать один из механизмов насыщения — уровень глюкозы растёт и есть перестаёт хотеться. Второй механизм — по срабатыванию датчика набитости желудка 8)). Ещё — фруктоза усваивается только печенью, так что при избытке калорий, там же в жир и откладывается. И какой вывод можно сделать? Если есть сколько надо, и регулировать калорийность своей пищи и количество движения, продукты с фруктозой вреда не принесут. А вот с реальными людьми так получается не всегда. Так кто виноват фруктоза или переедание? «Девушка была виновата в том, что мужчина к ней приставал — она была слишком красивой».
Второй механизм — по срабатыванию датчика набитости желудка 8)). Ещё — фруктоза усваивается только печенью, так что при избытке калорий, там же в жир и откладывается. И какой вывод можно сделать? Если есть сколько надо, и регулировать калорийность своей пищи и количество движения, продукты с фруктозой вреда не принесут. А вот с реальными людьми так получается не всегда. Так кто виноват фруктоза или переедание? «Девушка была виновата в том, что мужчина к ней приставал — она была слишком красивой».
Так что, однозначно — если Вы голодны и выпьете немного фруктозосодержащего напитка, это будет полезно. Избыток — нет. Немного добавлю фактов, что бы Вы могли более философски глянуть на публикации по фруктозе. Наш любимый сахар (химики его зовут- сахароза), это дисахарид, его молекула слеплена из одной молекулы глюкозы и одной фруктозы. В организме он обязательно расщепляется на фруктозу и глюкозу. И было это испокон веков. Пчелиный мед — как было где-то красиво определено — «отрыжка насекомых, из полупереваренных выделений половых органов растений». Хе-хе. Так вот, в мёде, фруктоза и глюкоза пополам. Фруктоза во фруктах — вообще, однозначно, полезна — яблоки, груши, инжир — содержат довольно много фруктозы. Так что, мне видится причина вреда — переедание, вызванное неестественно вкусными продуктами. И вот еще штрих. Мы об этом забыли, но это было, и было хорошо. Инвертный сахар. А что это такое? Раствор сахара кипятили с небольшим количеством серной кислоты. Да, при этом молекула сахарозы разваливалась на исходную фруктозу и глюкозу. Кислоту осаждали мелом. Избыток мела и получившийся гипс отфильтровывали. Как видите, ничего криминального. Гипс, мел — источники кальция. А в чём же смысл реакции? Получавшийся раствор был в полтора раза слаще исходного сахара. За счет сладости фруктозы и глюкозы.
Хе-хе. Так вот, в мёде, фруктоза и глюкоза пополам. Фруктоза во фруктах — вообще, однозначно, полезна — яблоки, груши, инжир — содержат довольно много фруктозы. Так что, мне видится причина вреда — переедание, вызванное неестественно вкусными продуктами. И вот еще штрих. Мы об этом забыли, но это было, и было хорошо. Инвертный сахар. А что это такое? Раствор сахара кипятили с небольшим количеством серной кислоты. Да, при этом молекула сахарозы разваливалась на исходную фруктозу и глюкозу. Кислоту осаждали мелом. Избыток мела и получившийся гипс отфильтровывали. Как видите, ничего криминального. Гипс, мел — источники кальция. А в чём же смысл реакции? Получавшийся раствор был в полтора раза слаще исходного сахара. За счет сладости фруктозы и глюкозы.
Так же происходит и у пчёл, только они используют специальный фермент. Такой раствор имеет ещё один неочевидный плюс. Он засахаривается гораздо медленнее, чем исходный сахарный сироп. Пчёлы это тоже знают, им работать с засахарившимся мёдом трудно — ложек и зубов нету. Почему засахаривается труднее? Вы только не обижайтесь( голосом Мкртчана — из Мимино), я Вам сейчас скажу одну очевидную для химика вещь: — Когда растёт кристалл -любого вещества — на его поверхность нарастают только молекулы того типа, из которых сложен этот кристалл. Во всяком случае они к этому стремятся. И сильно. Поэтому перекристаллизация, издревле, любимый способ очистки множества веществ. Растворили грязное, вырастили кристаллы, остатки отделили, кристаллы будут сильно чище. Так вот, когда у нас в растворе два разных сахара, возможные центры роста кристалла видят только свои молекулы и получается, что возможностей для роста кристаллов (засахаривания) в два раза меньше.
Почему засахаривается труднее? Вы только не обижайтесь( голосом Мкртчана — из Мимино), я Вам сейчас скажу одну очевидную для химика вещь: — Когда растёт кристалл -любого вещества — на его поверхность нарастают только молекулы того типа, из которых сложен этот кристалл. Во всяком случае они к этому стремятся. И сильно. Поэтому перекристаллизация, издревле, любимый способ очистки множества веществ. Растворили грязное, вырастили кристаллы, остатки отделили, кристаллы будут сильно чище. Так вот, когда у нас в растворе два разных сахара, возможные центры роста кристалла видят только свои молекулы и получается, что возможностей для роста кристаллов (засахаривания) в два раза меньше.
Немного про мёд. Мёд продукт исторически популярный и освящённый традицией. Ещё древние римляне лакомились напитком из мёда пополам с виноградным соком. И ничего у них не склеивалось. Нам трудно проникнуться теми ощущениями. Да, не было в те времена ничего столь же концентрированно сладкого и питательного, как мёд. Пища была достаточно грубой, с малым содержанием жиров и с очень малым количеством сладостей, поэтому съедение мёда вызывало необычно быстрый прилив сил и сытости. Даже от малого количества. В фильме «Легенда о Нараяме», люди чрезвычайно бедны, питаются почти одними трудноусвояемыми бобами. Одна из старушек собралась помирать. Плохо ей стало. Перед смертью ей сварили риса — гораздо более легко усвояемый продукт. Старушка поела и — ей стало хорошо, она выздоровела. Благодаря чудодейственной силе риса.
Пища была достаточно грубой, с малым содержанием жиров и с очень малым количеством сладостей, поэтому съедение мёда вызывало необычно быстрый прилив сил и сытости. Даже от малого количества. В фильме «Легенда о Нараяме», люди чрезвычайно бедны, питаются почти одними трудноусвояемыми бобами. Одна из старушек собралась помирать. Плохо ей стало. Перед смертью ей сварили риса — гораздо более легко усвояемый продукт. Старушка поела и — ей стало хорошо, она выздоровела. Благодаря чудодейственной силе риса.
Процесс сбора и приготовления мёда пчелами тоже впечатляющ. Ручная работа, да какая мелкая! Сначала пчела облетает тысячу цветков и собирает 70 миллиграмм нектара, отвозит его в улей, где специальные работники долго его жуют для ферментирования, потом раскладывают по сотам и упаривают до нужных кондиций, обмахивая крыльями. Запечатывают воском. И только тогда мёд готов. С химической же точки зрения мёд состоит в основном, из смеси фруктозы, глюкозы и совсем чуть других сахаров. Остальные вещества составляют около 3%. Боюсь навлечь гнев читателей, но не забудьте — я ведь химик: рекламные публикации о составе мёда невнятны и нелогичны, так же как и про гималайскую соль. Там есть немного ферментов, в основном, амилазы — мёд с горячим чаем, приводит к разрушению ферментов, которые там были (амилаза и другие, если дожили — их разрушить не трудно, даже небольшим нагревом). Опять же, фермент — это природный катализатор, ускоритель какой-то химической реакции. Ну есть в мёде фермент, расщепляющий крахмал до мальтозы и сахарозу на глюкозу и фруктозу, а нам от этого какая польза? Чуть лучше булка усвоится. Не за то любим. Бывает у людей и детей аллергия на мёд, бывает что им мёд не нравится. Не надо переживать, на свете есть много других полезных продуктов. Но! Давайте вспомним метафору о том, что человек есть сумма «харда» и «софта». Софт — это наши эмоции, чувства, убеждения и вера. Если Вам приятно и хорошо попить чаю с мёдом — пейте на здоровье, будет полезно. Как выбрать хороший мёд — не скажу, не знаю.
Боюсь навлечь гнев читателей, но не забудьте — я ведь химик: рекламные публикации о составе мёда невнятны и нелогичны, так же как и про гималайскую соль. Там есть немного ферментов, в основном, амилазы — мёд с горячим чаем, приводит к разрушению ферментов, которые там были (амилаза и другие, если дожили — их разрушить не трудно, даже небольшим нагревом). Опять же, фермент — это природный катализатор, ускоритель какой-то химической реакции. Ну есть в мёде фермент, расщепляющий крахмал до мальтозы и сахарозу на глюкозу и фруктозу, а нам от этого какая польза? Чуть лучше булка усвоится. Не за то любим. Бывает у людей и детей аллергия на мёд, бывает что им мёд не нравится. Не надо переживать, на свете есть много других полезных продуктов. Но! Давайте вспомним метафору о том, что человек есть сумма «харда» и «софта». Софт — это наши эмоции, чувства, убеждения и вера. Если Вам приятно и хорошо попить чаю с мёдом — пейте на здоровье, будет полезно. Как выбрать хороший мёд — не скажу, не знаю.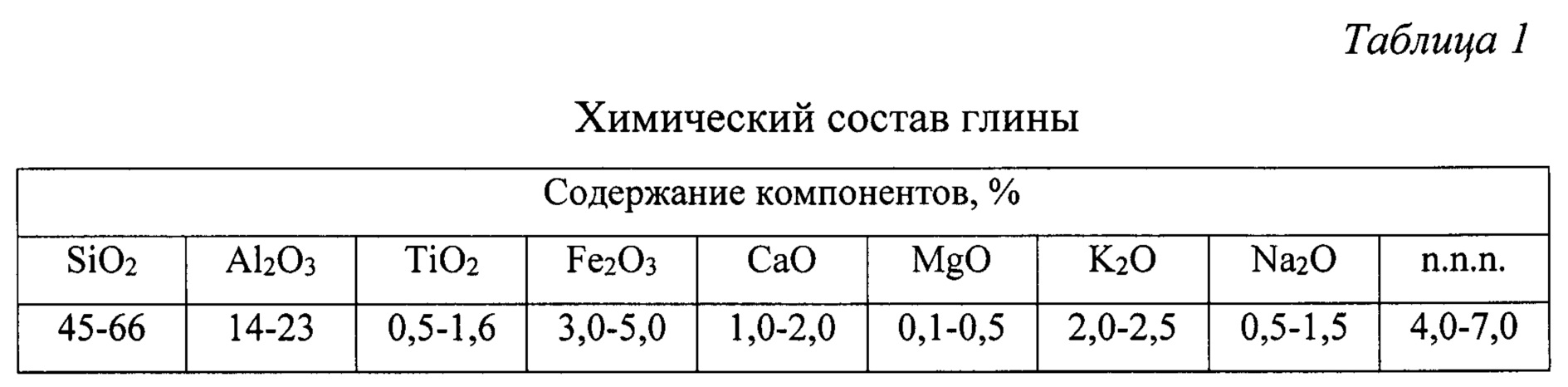 Я его вообще не покупаю, у жены дядька — пасечник. Дарит.
Я его вообще не покупаю, у жены дядька — пасечник. Дарит.
Немного скажу о других сахаридах, различных ди- и трисахаридах. Например в горохе есть некий трисахарид, который, нами в большинстве, не усваивается. А вот микробы кишечника начинают его жадно лопать. Результат — бурчание в животе, и не побоюсь этого выражения: — «испускание ветров». В молоке другой сахар — лактоза, который усваивается далеко не всеми людьми. То есть, маленькие дети имеют фермент для его расщепления, а у взрослых его активность может падать совсем. Вообще, мутация, позволяющая усваивать молочный сахар появилось в Европе 5000 лет назад, и связана с одомашниванием молочного скота. Так что, если у вас от молока болит живот — Вы не европеец. А если Вы можете пить молоко литрами — то Вы мутант-европеец. Это шутка такая.
Уйдём теперь от этих ужасных проблем к нашей простой, доброй милой сахарозе. Итак добывают её двумя способами: — первый нам наиболее привычный и известный — из сахарной свёклы(она -белая). Кстати, Вы её пробовали?
Кстати, Вы её пробовали?
Сахарная свёкла — на вкус не очень
Но сладкая. Так вот, из свекольной стружки вымывают сахар. Получившийся коричневый раствор, очищают от примесей известью, углекислым и сернистым газом — сернистый газ, это вонючий газ получающийся при сгорании серы, им чистят подвалы и теплицы от всяких грибков и вредителей, придают дивный светлый цвет кураге и изюму. Вреда от него особого нет, он благополучно нейтрализуется и переходит в безвредные сульфаты. Так вот, раствор упаривают, и для получения рафинированного сахара, обрабатывают активированным углем. Он связывает на своей поверхности все красящие и вонючие вещества и получается совсем прозрачный раствор. Кстати, свекловичный сахар, традиционно очищают углём из твёрдых пород дерева, а вот рафинированный тростниковый(который становится совсем белым), по- традиции очищают костным углем. Углем, полученным при пережигании костей животных(по большей части коров, вероятно- не бойтесь, там ничего органического не остается, уголь, фосфаты кальция, всё нерастворимое). Так что свекловичный сахар можно считать вполне себе постным(вегетарианским?). Ну и нерафинированный тростниковый, потому что в процессе их приготовления животные не были задействованы. На самом деле вопрос постности сахара решается сугубо директивно, я думаю. Вернёмся к очищенному сахарному сиропу — его упаривают, вносят затравку кристаллов сахара, выпадающие кристаллы отделяют и сушат. Вот и получился рафинированный сахар-песок. Раньше из него делали твёрдый сахар-рафинад. Смешивали сахар-песок с сахарным сиропом. Вещь получалась по твёрдости — ядрёная и экономичная. Пока растворишь или сгрызёшь кусок, выпьешь три стакана чая. Теперь кусковой, быстрорастворимый сахар делают обработкой сахара -песка паром и прессованием. Получается гораздо более удобосъедаемый продукт.
Так что свекловичный сахар можно считать вполне себе постным(вегетарианским?). Ну и нерафинированный тростниковый, потому что в процессе их приготовления животные не были задействованы. На самом деле вопрос постности сахара решается сугубо директивно, я думаю. Вернёмся к очищенному сахарному сиропу — его упаривают, вносят затравку кристаллов сахара, выпадающие кристаллы отделяют и сушат. Вот и получился рафинированный сахар-песок. Раньше из него делали твёрдый сахар-рафинад. Смешивали сахар-песок с сахарным сиропом. Вещь получалась по твёрдости — ядрёная и экономичная. Пока растворишь или сгрызёшь кусок, выпьешь три стакана чая. Теперь кусковой, быстрорастворимый сахар делают обработкой сахара -песка паром и прессованием. Получается гораздо более удобосъедаемый продукт.
Сахарный тростник
С тростниковым сахаром всё похоже и всё по-другому. Это был первый вид сахара, который люди начали делать. Получают его из сока сахарного тростника. Получается, густой коричневый сироп. Но вкус у него приятный, хотя цвет очень тёмный. Такой сироп бывает в магазине, но перед покупкой приглядитесь — должно быть написано, что он сделан конкретно из сахарного тростника. Ещё продают нерафинированный тростниковый сахар. А так же продается тёмный кусковой тростниковый сахар, его кажется делают из смеси рафинированного и тростникового сиропа, приятный на вкус.
Но вкус у него приятный, хотя цвет очень тёмный. Такой сироп бывает в магазине, но перед покупкой приглядитесь — должно быть написано, что он сделан конкретно из сахарного тростника. Ещё продают нерафинированный тростниковый сахар. А так же продается тёмный кусковой тростниковый сахар, его кажется делают из смеси рафинированного и тростникового сиропа, приятный на вкус.
Тёмный тростниковый кусковой сахар
С ценой интересная зависимость получается — чем продукт ближе к высушенному тростниковому соку, тем он дороже… Хотя не логично до крайности. Чем больше мы возимся на заводе с тростниковым сахаром, тем дешевле он становится… Парадоксы маркетинга. А вот ещё более тёмный продукт — фариновый сахар. Мягкая сахарная паста тёмного цвета. Тоже из тростника.
Фариновый сахар
Бывает ещё — Крупный карамельный сахар. Крупные, красивые кристаллы золотисто-тёмного цвета. Увы цвет в этом случае получается из-за добавки карамелизованного (нагреванием) сахара и не связан с веществами из тростниковой травки, а значит и вкус у него — сахарный.
Крупный карамельный сахар
На этом тему закончим — хотя есть ведь ещё и несахарные подсластители… может когда-нибудь поговорим и об этом. А вывод у нас будет такой: все сахара, вещь в некотором роде, искусственная, яблоко всяко полезнее, а уж если хотите съесть сахара выбирайте тот, который нравится. Вкус или цвет — тоже могут нести положительные эмоции, а это, согласитесь — хорошо.
Cпасибо за внимание. Теперь буду думать о следующем посте. Больше готовых у меня нет, так что когда будет — не знаю, это как Музы распорядятся. Предыдущий пост смотрите
Чистые вещества и смеси в химии
Чистые вещества и смеси:
Человек постоянно встречает в жизни новые вещества и их смеси. Это объясняется тем, что в природе чистые вещества встречаются редко и большинство знакомых нам вещей являются смесью этих веществ.
Возьмите два химических стакана. В каждый из химических стаканов вначале влейте определённое количество воды. После этого в эти стаканы добавьте немного песка и сахара и размешайте. Что вы наблюдаете? Какова разница между исходными веществами и смесями, образовавшимися в химических стаканах? Как можно выделить из состава полученной смеси входящие в неё вещества?
Что вы наблюдаете? Какова разница между исходными веществами и смесями, образовавшимися в химических стаканах? Как можно выделить из состава полученной смеси входящие в неё вещества?
В зависимости от постоянства физических свойств вещества делятся на 2 части (схема 1):
Чистые вещества обладают постоянными, а смеси — непостоянными физическими свойствами. Например, кислород при температуре — 182,9 С закипает, однако, так как в составе воздуха содержится смесь различных газов, температура его кипения непостоянна. Каждое чистое вещество обладает лишь присущими ему физическими свойствами и именно по этим свойствам его можно отличить от другого вещества: для уксусной кислоты — это запах, для поваренной соли — вкус, для меди — цвет и высокая электропроводность и т.д.
Смеси бывают двух видов: однородные и неоднородные. Частицы веществ, составляющих однородные смеси, невозможно различить невооружённым глазом и даже под микроскопом. Например, смесь из поваренной соли и воды (рис. 1).
1).
Частицы же веществ, составляющих неоднородные смеси, можно различить как простым глазом, так и при помощи микроскопа. Например, смесь из масла и воды. Однородные и неоднородные смеси можно разложить на составные части разными методами (схемы 2, 3).
Выпаривание — данный метод применяется в тех случаях, когда твёрдое вещество находится в растворенном состоянии. Например, для выделения соли из солёной воды однородную смесь нагревают. В данном случае вода полностью выпаривается, а на дне посуды остаются белые кристаллики соли (рис. 2).
Выделение газов ( и др.) из их смеси с водой также происходит методом выпаривания. При этом из смеси в первую очередь выделяется газ.
Кристаллизация — данный метод применяется в тех случаях, когда твёрдое вещество находится в жидкостях в растворённом состоянии. При таком методе воду из раствора выпаривают частично и полученный новый концентрированный раствор охлаждают. В таком случае выделяемое вещество оседает на дно в виде кристаллов. Путём кристаллизации получают более чистое вещество. Например, таким способом можно выделить сахар из его водного раствора.
В таком случае выделяемое вещество оседает на дно в виде кристаллов. Путём кристаллизации получают более чистое вещество. Например, таким способом можно выделить сахар из его водного раствора.
Дистилляция — данный метод применяется для выделения растворенных друг в друге веществ, обладающих разными температурами кипения (рис. 3). Метод дистилляции основан на различии в температурах кипения жидкостей в составе смеси. Например, этот метод можно использовать для разделения однородной смеси воды и этилового спирта. Потому что температуры кипения этих веществ разные. Вначале смесь нагревается. В таком случае в первую очередь выпаривается этиловый спирт, обладающий более низкой температурой кипения, т.е. закипающий при 78, и являющийся более летучей жидкостью. Выделяющиеся спиртовые пары, подвергаясь сжижению в холодильнике, собираются в посуду.
Хроматография — данный метод основан на способности адсорбции (поглощения) с различной скоростью отдельных веществ, составляющих смесь, на поверхности другого вещества и их десорбции (выделения). При помощи метода хроматографии можно разделить однородные жидкие смеси и смеси газов на составные части (рис. 4).
При помощи метода хроматографии можно разделить однородные жидкие смеси и смеси газов на составные части (рис. 4).
Отстаивание — этот метод основан на различии плотностей жидкостей. Данный метод можно использовать в двух случаях:
а) при разделении нерастворимых друг в друге жидких веществ с разными плотностями. Для этого пользуются делительной воронкой. Например, выделение растительного масла из его смеси с водой, сливок из молока и др. (рис. 5).
б) при разделении посредством воды двух не растворяющихся в воде твёрдых веществ с разными плотностями. Например, смесь из железного порошка и древесных опилок можно разделить, добавив в эту смесь воду (рис. 6). Вещество с малой плотностью всплывёт на поверхность, а вещество с более высокой плотностью осядет на дно.
Процеживание (фильтрация) — данный метод используется для отделения нерастворимых в воде твёрдых веществ. Например,
песок + вода, сера + вода, железный порошок + вода, глина + вода, известняк + вода, древесные опилки + вода.
При процеживании (фильтрации) используют фильтровальную бумагу. Во время процеживания смеси твёрдое вещество остаётся на поверхности фильтровальной бумаги (рис.7). Данным методом можно разделить смесь из двух разных веществ, одно из которых растворяется, а другое — не растворяется в воде. Например, для разделения смеси из соли и песка, в эту смесь вначале добавляют воду и размешивают, а затем полученную новую смесь процеживают через фильтровальную бумагу. Во время процеживания песок остаётся на поверхности фильтровальной бумаги, а солёная вода проходит через неё.
Воздействие магнитом — этим методом пользуются для отделения железа из его смеси с твёрдыми веществами (рис. 8). Например, железный порошок+серный порошок, железный порошок + древесные опилки, железный порошок + песок. Путём воздействия магнитом можно разделить эти смеси на составные части. В этом случае железный порошок притягивается магнитом, а другое вещество — нет.
Такие смеси, как глина + вода, песок + вода, мел + вода, можно разделить также методом осаждения. Смесь оставляется на некоторое время в нетронутом виде, нерастворимое в воде вещество оседает на дно.
Смесь оставляется на некоторое время в нетронутом виде, нерастворимое в воде вещество оседает на дно.
Урок химии в 9 классе «Силикатная промышленность», УМК Габриелян О.С.
Силикатная промышленность. Работу выполнила Олифирова Ольга Владимировна учитель МОУ «СОШ №2» городского округа ЗАТО п. Горный.
Найдите и исправьте 6 ошибок в ответе учащегося: «Графит и кремний – твердые, химически неактивные вещества, реагирующие с другими веществами только при нагревании, оба реагируют с кислородом, водородом, металлами. Их высшие оксиды также сходны: имеют одинаковое агрегатное состояние, тип кристаллической решетки и химические свойства. Оба оксида растворяются в воде, щелочах. Им соответствуют слабые кислоты, причем угольная кислота слабее кремневой».
Лабораторная работа «Ознакомление с природными соединениями кремния».
Цель: Ознакомиться с образцами природных соединений.
Оборудование: кварц, полевой шпат, каолинит.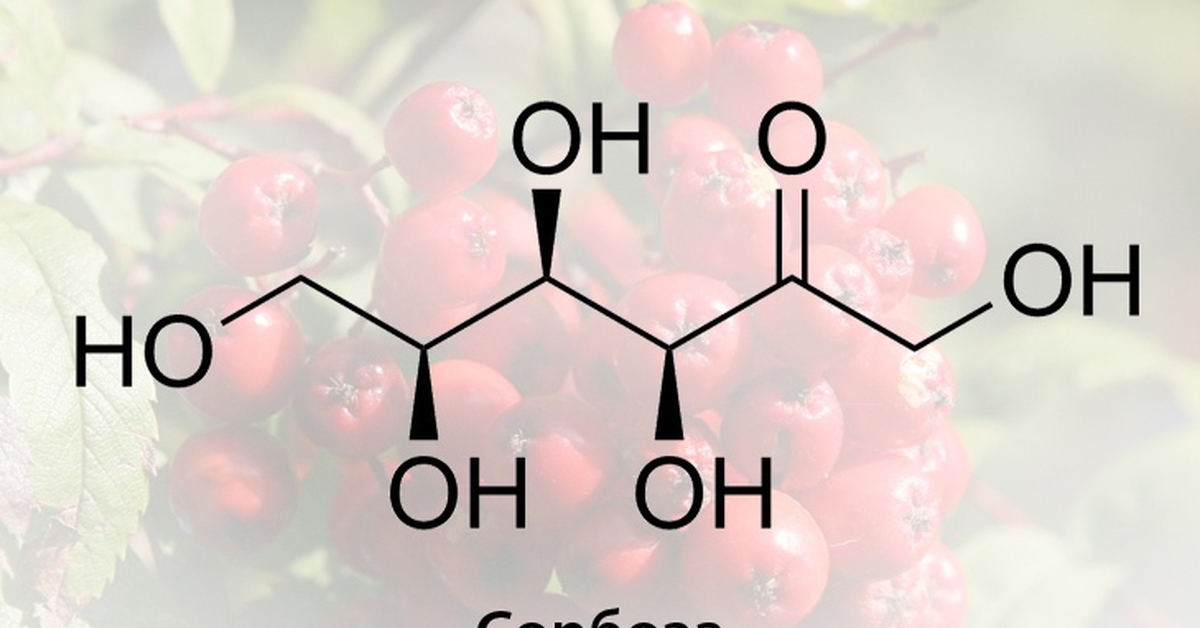 Ход работы.
Рассмотрите выданные образцы природных силикатов.
Заполните таблицу.
Название минерала
Формула и название основной составной части
Внешний вид
Применение.
Кварц
Полевой шпат
Каолинит
Ход работы.
Рассмотрите выданные образцы природных силикатов.
Заполните таблицу.
Название минерала
Формула и название основной составной части
Внешний вид
Применение.
Кварц
Полевой шпат
Каолинит
Силикатная промышленность занимается переработкой природных соединений кремния. Основные направления – это производство
Заполнить таблицу «Силикатная промышленность» Основные направления силикатной промышленности Сырье Этапы производства Виды промышленной продукции и ее применение Строительные материалы Изделия быта Керамика Стекло Цемент
ПРОИЗВОДСТВО КЕРАМИКИ
Керамика -(от греческого слова «керамон» — глина). Сырье:
Глина (смеси глинистых минералов состава Al2O3·3-5SiO2·nh3O)
Белая глина (каолин) Al2O3·2SiO2·2h3O
Речной песок
Оксиды железа
Сода Na2CO3
Поташ К2СО3
Сырье:
Глина (смеси глинистых минералов состава Al2O3·3-5SiO2·nh3O)
Белая глина (каолин) Al2O3·2SiO2·2h3O
Речной песок
Оксиды железа
Сода Na2CO3
Поташ К2СО3
Основные стадии производства.
Области применения керамики
Фарфор
Фаянс.
ПРОИЗВОДСТВО СТЕКЛА. Важные свойства стекла: -не имеют определённой температуры плавления; -высокая прочность; -значительная механическая прочность; -стойкость к химическим реактивам; -низкая теплопроводность; -хрупкость;
Сырье для стекла. Основой обычных стекол являются силикаты натрия, калия и кальция. Исходными веществами для получения стекла служит сода, известняк и песок. В стекло часто вводят различные добавки, которые улучшают и изменяют свойства обычного стекла. Например, добавки кобальта окрашивают стекло в синий цвет, марганца – в фиолетовый, Cr2O3- в изумрудно – зеленый.
Введение в стекло плавикового шпата CaF2 делает его непрозрачным. Добавки оксидов кальция, бария, магния повышают механическую прочность стекла. Стекла с добавлением оксида свинца используются для защиты от рентгеновских лучей. Заменой соды на К2СО3, а СаСО3 на РbО, получают хрусталь, широко используемый для изготовления художественной посуды.
Введение в стекло плавикового шпата CaF2 делает его непрозрачным. Добавки оксидов кальция, бария, магния повышают механическую прочность стекла. Стекла с добавлением оксида свинца используются для защиты от рентгеновских лучей. Заменой соды на К2СО3, а СаСО3 на РbО, получают хрусталь, широко используемый для изготовления художественной посуды.
Добавки оксидов кальция, бария, магния повышают механическую прочность стекла. Стекла с добавлением оксида свинца используются для защиты от рентгеновских лучей. Заменой соды на К2СО3, а СаСО3 на РbО, получают хрусталь, широко используемый для изготовления художественной посуды.
Введение в стекло плавикового шпата CaF2 делает его непрозрачным. Добавки оксидов кальция, бария, магния повышают механическую прочность стекла. Стекла с добавлением оксида свинца используются для защиты от рентгеновских лучей. Заменой соды на К2СО3, а СаСО3 на РbО, получают хрусталь, широко используемый для изготовления художественной посуды.
Кварцевое стекло – получают из чистого песка. Расплавленный песок, остывая, образует стекловидную массу. В отличие от обычного стекла кварцевое стекло мало изменяется в объеме при изменении температуры.
Кварцевое стекло – получают из чистого песка. Расплавленный песок, остывая, образует стекловидную массу. В отличие от обычного стекла кварцевое стекло мало изменяется в объеме при изменении температуры.
Основные стадии производства
Области применения стекла.
ПРОИЗВОДСТВО ЦЕМЕНТА. Цемент известен как широко применяемый строительный материал, его вяжущие свойства используются для скрепления между собой твердых предметов. Основным сырьём для производства цемента являются известняк(CaCO3) и глина, содержащая оксид кремния (IV).
Основные стадии производства
Области применения цемента
Из предложенных утверждений выберите правильные.
1) Силикатная промышленность включает в себя производство стека, керамики, фарфора и фаянса.
2) Сырьем для производства обычного стекла служат чистый кварцевый песок, сода и известняк.
3) Если в качестве сырья берут поташ, оксид свинца (II) и песок, то получают хрустальное стекло.
4) Керамику изготавливают на основе песка с добавлением соды и известняка.
5) Основным строительным материалом являются цемент, бетон и железобетон.
6) Оксид кремния имеет невысокую температуру плавления, поэтому производство стекла ведут при температуре 150 0С. 7) У стекла нет постоянной температуры затвердевания, и загустевающему, вязкому стеклу можно придать любую форму.
8) Кварцевое стекло используют для изготовления лабораторного оборудования.
9) Печи кладут из силикатного кирпича.
10) Для приготовления цветных стекол к сырью добавляют хлориды соответствующих металлов.
7) У стекла нет постоянной температуры затвердевания, и загустевающему, вязкому стеклу можно придать любую форму.
8) Кварцевое стекло используют для изготовления лабораторного оборудования.
9) Печи кладут из силикатного кирпича.
10) Для приготовления цветных стекол к сырью добавляют хлориды соответствующих металлов.
1) Силикатная промышленность включает в себя производство стека, керамики, фарфора и фаянса.
2) Сырьем для производства обычного стекла служат чистый кварцевый песок, сода и известняк.
3) Если в качестве сырья берут поташ, оксид свинца (II) и песок, то получают хрустальное стекло.
4) Керамику изготавливают на основе песка с добавлением соды и известняка.
5) Основным строительным материалом являются цемент, бетон и железобетон.
6) Оксид кремния имеет невысокую температуру плавления, поэтому производство стекла ведут при температуре 150 0С.
7) У стекла нет постоянной температуры затвердевания, и загустевающему, вязкому стеклу можно придать любую форму. 8) Кварцевое стекло используют для изготовления лабораторного оборудования.
9) Печи кладут из силикатного кирпича.
10)Для приготовления цветных стекол к сырью добавляют хлориды соответствующих металлов.
8) Кварцевое стекло используют для изготовления лабораторного оборудования.
9) Печи кладут из силикатного кирпича.
10)Для приготовления цветных стекол к сырью добавляют хлориды соответствующих металлов.
Кремний и его соединения
Кремний и его соединения
Автор: edu2
Методическая копилка — Химия
Разработка урока по химии в 9 классе
УМК О.С.Габриелян «Химия 9 кл.»
Тема «Кремний и его соединения»
Тип урока: лекция (включает элементы беседы и лабораторный опыт)
Цели урока: — дать общую характеристику кремния;
— рассмотреть природные соединения кремния;
— провести сравнительный анализ с соединениями углерода;
— изучить особенности строения, свойства, способы получения и области применения кремния и его соединений: SiH4, SiO2, H2SiO3.
Задачи урока:
Образовательные:
- Сформировать представления учащихся о кремнии как о химическом элементе
- Продолжить формирование умений давать характеристику химическому элементу по положению его в периодической системе, составлять схему строения атома.
- Ознакомить учащихся с физическими и химическими свойствами кремния.
- Ознакомить учащихся с наиболее значимыми соединениями кремния и их применением.
Развивающие:
- Развивать умение определять закономерность между составом, строением, свойствами и применением веществ.
- Продолжить формирование умений учащихся анализировать, сравнивать, делать выводы.
Воспитательные:
- Воспитывать умения аккуратно вести записи в тетради.
- Формировать у учащихся познавательной активности к изучаемому предмету путем привлечения их в творческий процесс и знакомства с краеведческим материалом.

Оборудование: авторская презентация «Кремний и его соединения», реактивы: раствор соляной кислоты, раствор силикатного клея; штатив с пробирками; образцы природных соединений кремния ( гранит, горный хрусталь, кварц и др.), образцы изделий из стекла, фаянса, фарфора, керамики.
Ход урока:
- Вводная часть (слайд 1)
Подсказка. Представьте себе — встает человек утром с постели, подходит к зеркалу, а вместо него — пустая рамка, ищет очки, а от них лишь одна оправа; вдруг он ощущает порывы ветра, так как в доме нет ни одного окна; от ужаса человек хочет выпить глоток воды, но не может найти ни одной чашки, стакана — вообще нет никакой в доме посуды — все бесследно исчезло! И это только начало ужаса.
Далее треск, грохот — рушатся потолок, стены, они летят и рассыпаются, превращаясь в пыль и песок. Параллельно с этим выделяется огромное количество кислорода, который меняет состав воздуха, то есть земной атмосферы!
А самое страшное, что в последствии почти целиком исчезает земная кора, испаряются океаны и не существует больше жизнь на Земле.
Что это за элемент и почему его исчезновение могло вызвать такие катастрофические изменения? Подсказка. Что объединяет объекты на слайде между собой?
Учащиеся (предполагаемый ответ): Все объекты на слайде состоят из веществ, в состав которых входит кремний и элемент, о котором идет речь в рассказе, — кремний.
— Сегодня мы познакомимся с ещё одним неметаллом, значимость которого очень велика, т.к. по распространенности на Земле он второй после кислорода, — это кремний.
2.Кремний – химический элемент
1) Строение и свойства атома кремния (слайд 2-8)
Латинское название «силициум» берёт своё начало от латинского «силекс» — камень. С греческого языка «кремнос» — утёс, скала.
1 ученик у доски: характеристика положения кремния в таблице химических элементов
Д.И. Менделеева, возможные степени окисления, построение электронной формулы атома кремния.
2 ученик делает обобщение:
-У кремния электроны расположены на трёх энергетических уровнях, а у углерода – на двух, следовательно, окислительные (неметаллические) свойства у кремния выражены слабее, а восстановительные (металлические) – сильнее.
2) Нахождение в природе (слайды 9-14)
(материал о биологическом значении кремния в организме человека готовиться учащимися за ранее)
— Земная кора на одну четверть состоит из соединений кремния. Наиболее распространённым является оксид кремния (IV) – кремнезём. В природе он образует минерал кварц и многие другие разновидности: горный хрусталь, аметист, агат, опал, яшма, халцедон, сердолик (полудрагоценные камни), а также обычный кварцевый песок.
Именно кремень положил начало каменному веку. Причин этому две: доступность и распространённость, а также способность образовывать на сколе острые режущие края.
Второй тип природных соединений кремния – силикаты. Самые распространённые алюмосиликаты: гранит, различные виды глин, слюды. Не содержащий алюминия силикат – асбест (из него изготавливают огнестойкие ткани)
Кремний придаёт гладкость и прочность костям человека, входит в состав низших живых организмов – диатомовых водорослей и радиолярий (образует их скелеты) .
3.Кремний – простое вещество(15-32)
1)Аллотропные модификации кремния
2)Строение кристаллического кремния
3)Физические свойства
— Вы обратили внимание, что когда мы говорим о содержании в природных условиях элемента кремния, то упоминаем только его соединения, но не простое вещество.
Кремний в свободном виде в природе не встречается в отличие от углерода (алмаз,
графит, аморфный С и т.д.)
Кремний – неметалл, существует в кристаллическом и аморфном виде.
Кристаллический кремний – серовато-стального цвета с металлическим блеском, твёрдый (7 баллов по шкале Мооса), но хрупкий, малореакционноспособный; полупроводник, (с повышением температуры электропроводность повышается), и с нарушением правильности структуры.
Такие свойства обусловлены строением кристаллов, аналогичным структуре алмаза.
Физические константы: g = 2,33 г/см3; tпл. = 1415 0С; t кип.= 3500 0С
= 1415 0С; t кип.= 3500 0С
Аморфный кремний представляет собой порошок.
4) Открытие кремния
— Уже в глубокой древности люди широко использовали в своём быту соединения кремния. Вспомните древних людей. Из чего были изготовлены их орудия труда? Но сам кремний впервые был получен в 1824 г. Шведским химиком И.Я. Берцелиусом. Однако, за 12 лет до него кремний получили Ж. Гей-Люссак и Л. Тенар, но он был очень загрязнён примесями.
5) Получение кремния
— Способы получения кремния основаны в основном на восстановлении оксида кремния (IV) сильными восстановителями – активными металлами (Mg, Al) и углеродом.
Лабораторный способ: SiO2 + 2Mg = 2MgO + Si
Промышленный способ: SiO2 + 2C →t2CO + Si
6) Химические свойства
а) кремний — восстановитель
Все реакции протекают при нагревании!
- Si + O2 = SiO2 (оксид кремния (IV))
Si0 – 4e— Si+4 восстановитель
O2 + 4e— 2O-2 окислитель
- Si + 2Г2 = SiГ4 (галогенид кремния)
- Si + 2NaOH(конц.
 ) + H2O = Na2SiO3 + 2H2 ↑
) + H2O = Na2SiO3 + 2H2 ↑
б) кремний – окислитель
Si + 2Ca = Ca2Si (силицид кальция)
Вывод: свойства кремния и углерода похожи. Оба неметалла взаимодействуют с кислородом, галогенами, металлами. Но в отличие от углерода кремний напрямую не соединяется с водородом.
4.Соединения кремния (33-44)
1) Силан SiH4
-Силан получают косвенно, действуя на силициды металлов водой или кислотами:
Mg2Si + 4H2O = 2Mg(OH)2 + SiH4
Силан – бесцветный газ, самовоспламеняющийся на воздухе и сгорающий с образованием оксида кремния и воды:
SiH4 + 2O2 = SiO2 + 2H2O
2) Свойства кремнезёма
Рассматриваются свойства оксида кремния (IV) и проводится сравнительный анализ двух оксидов – SiO2 и CO2.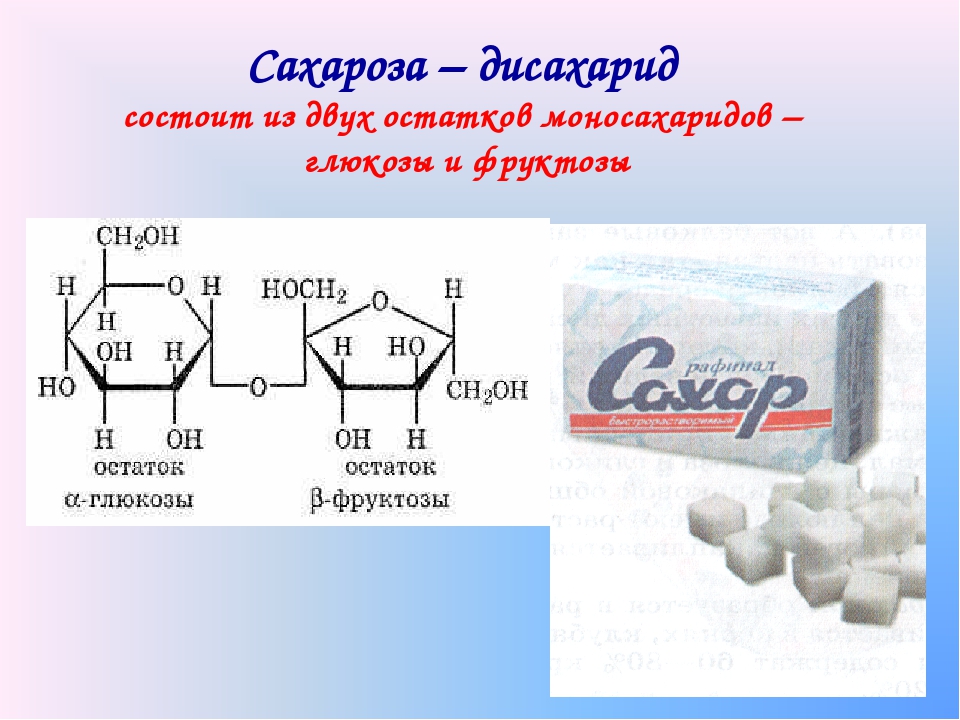 Результаты обсуждения в виде таблицы выводятся на экран.
Результаты обсуждения в виде таблицы выводятся на экран.
Обратите внимание на одно важное свойство оксида кремния:
SiO2 + 4HF = 2H2O + SiF4
Оксид кремния входит в состав стекла, поэтому плавиковую кислоту нельзя хранить в стеклянной посуде.
Оксид кремния (IV) необходим и растениям, и животным. Он придаёт прочность стеблям растений и покровам животных ( камыши твёрдо стоят, осока режет, как лезвие, чешуя рыб, панцири насекомых, крылья бабочек, перья птиц, шерсть животных содержат оксид кремния (IV).
Вывод: физические свойства оксидов резко отличаются, т.к. они образуют разные кристаллические решётки – молекулярную (CO2) и атомную (SiO2), но химические свойства схожи. Отличие состоит в различном отношении к воде.
3) Кремниевая кислота и её соли
-кремниевая кислота H2SiO3 —единственная нерастворимая неорганическая кислота, — двухосновная,
— слабая H2SiO3 →tH2O +SiO2
При высыхании образует силикагель, используемый в качестве адсорбента.
Получить кремниевую кислоту можно только из её солей.
Проведение лабораторного опыта и составление уравнения реакции получения кремниевой кислоты (самостоятельно, на доске)
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
SiO32- + 2Н+ = H2SiO3
Соли кремниевой кислоты называют силикатами
Их можно получить сплавлением оксида кремния с оксидами металлов или карбонатами:
SiO2 + CaO = CaSiO3
SiO2 + CaCO3 = CaSiO3 + CO2
5.Применение соединений кремния в народном хозяйстве (слайды 45-47)
6. Заключительные выводы (слайд 48-49)
7. Самоконтроль (слайд 50)
8. Д/з (слайд 51)
Приложение 1.
Инструктивная карта по теме «Кремний и его соединения»
обучающегося _________ класса__________________________________________
(фамилия и имя)
|
Углерод и его соединения |
Кремний и его соединения |
|
1.Химический
1) Положение в ПСХЭ:2 период, IVA группа 2) Строение атома +6 С ) ) 1s22s22p2 2e 4e 3) Свойства атома Является элементом неметаллом Высшая СО = + 4 Низшая СО = – 4 4) Нахождение в природе Углерод – элемент жизни 2. Алмаз – твердый, очень прочный, прозрачный, не обладает электропроводностью и теплопроводностью. Графит – темно-серого цвета, имеет металлический блеск, мягкий, проводит тепло и электрический ток. 2) Строение Имеют атомную кристаллическую решетку. 3) ПолучениеSiO2 +3C = Si + C + 2CO (получение графита) 4) Химические свойства1. восстановительные:
2. окислительные:
3. Оксид углерода (IV) СО2 – кислотный оксид СтроениеМолекулярная кристаллическая решетка Физические свойстваГаз, при обычных условиях легко сжижается и затвердевает, в воде растворяется, тяжелее воздуха. Химические свойства1)Взаимодействие с водой СО2 + Н2О ↔ Н2СО3 2)Взаимодействие с основными оксидами СаО + СО2 = СаСО3↓ 3)Взаимодействие со щелочами 2КОН + СО2 = К2СО3 + НО 4) Взаимодействие с магнием 2Mg + CO2 = 2MgO + C 5)Взаимодействие с углеродом CO2 + C = 2CO 4. Кис Угольная кислота Н2СО3 Двухосновная, кислородсодержащая, слабая, летучая
Получение Может быть вытеснена из состава соли более сильными кислотами СаСО3 + 2 НCl = СaСl2 + Н2СО3 СО2↑ Н2О Химические свойства1)При нагревании разлагается: Н2СО3 ↔ СО2↑+ Н2О 2)Взаимодействие со щелочами: 2NaOH+H2CO3=Na2CO3 + 2H2O
|
элемент
1) Положение в ПСХЭ: 2)Строение атома +… Si 3) Свойства атома Является элементом…………………. Высшая СО = …… Низшая СО = …… 4) Нахождение в природе: вещества 1) Физические свойстваКристаллический кремний ….
Аморфный кремний……………
2) Строение Имеет ……………… кристаллическую решетку. 3) Получение1)в промышленности: 2)в лаборатории:
4) Химические свойства 1. восстановительные: 2. окислительные:
ды Оксид кремния (IV) …. — …………………… Строение……………… кристаллическая решетка Физические свойстваХимические свойства 1) Взаимодействие с водой 2) Взаимодействие с основными оксидами 3) Взаимодействие со щелочами 4) Взаимодействие с магнием 5) Взаимодействие с углеродом 6) взаимодействие с плавиковой кислотой лоты
Кремниевая кислота……… …………………………………………………
Получение Химические свойства1)При нагревании разлагается: 2) Взаимодействие со щелочами:
|
Самоконтроль
1. Какое место занимает кремний в периодической системе:
Какое место занимает кремний в периодической системе:
а) 2 период, 4Б гр. б) 3 период, 3А гр. в) 3 период, 4А гр.
2. Кристаллическая решетка кремния и его соединений :
а) ионная; б) атомная; в) молекулярная
3. По распространенности в природе кремний …. элемент:
а) первый; б) второй; в) третий
4. Кремний вступает в реакцию с:
а) металлами, водородом, галогенами;
б) металлами, галогенами, легко растворяется в щелочах;
в) оксидами, кислотами, неметаллами
5. Соли кремниевой кислоты:
а) силициды; б) гидрокарбонаты; в) силикаты
Какая формула у песка? — AnswersToAll
Какая формула у песка?
sio2 – это формула песка.
Что такое песок в химии?
ХИМИЧЕСКИЙ ГЛОССАРИЙ Песок представляет собой рыхлые частицы твердой, битой породы или минералов диаметром от 0,02 мм до 2 мм. Песок является наиболее распространенной формой кремнезема, используемой в производстве стекла.
Песок является наиболее распространенной формой кремнезема, используемой в производстве стекла.
Почему его называют песком?
Считается, что слово «песок» произошло от древнеанглийского слова, которое, в свою очередь, произошло от древнеголландского слова sant, ставшего zand (что означает, как вы уже догадались, песок).Затем это слово стало означать нечто более тонкое, чем гравий, но более крупное, чем пыль.
Какова формула известняка?
Известняк состоит из карбоната кальция, имеющего химическую формулу CaCO3.
Какое химическое название песка?
Диоксид кремния — это химическое название песка. Химической формулы песка не существует. По умолчанию формула песка рассматривается как sio2. Песок представляет собой смесь нескольких различных минералов. песок имеет различный цвет в зависимости от местоположения.
Какова формула кремнезема в песке?
В песке этот кремнезем обычно существует в форме кварца. Кварц имеет химическую формулу SiO2 и имеет кристаллическую структуру, в которой каждый атом кремния присоединен к четырем атомам кислорода, а каждый атом кислорода присоединен к двум атомам кремния. В некоторых странах песок также состоит из карбоната кальция.
В некоторых странах песок также состоит из карбоната кальция.
Какова химическая формула карбонатно-кальциевого песка?
В некоторых странах песок также состоит из карбоната кальция.Химическая формула карбоната кальция – CaCO3. Дополнительная информация от Reference.com Какие документы необходимы для предварительного одобрения ипотеки?
Какой компонент песка является наиболее распространенным?
Состав песка варьируется в зависимости от местных источников горных пород и условий, но наиболее распространенным компонентом песка во внутренних континентальных условиях и нетропических прибрежных условиях является кремнезем (диоксид кремния или SiO2), обычно в форме кварца.
Что такое песок в химии? – Рестораннорман.
 ком
комЧто такое песок в химии?
ХИМИЧЕСКИЙ ГЛОССАРИЙ Песок представляет собой рыхлые частицы твердой, битой породы или минералов диаметром от 0,02 мм до 2 мм. Песок является наиболее распространенной формой кремнезема, используемой в производстве стекла.
Из каких компонентов состоит песок?
Наиболее распространенным компонентом песка является диоксид кремния в форме кварца. Массивы суши Земли состоят из горных пород и минералов, включая кварц, полевой шпат и слюду. Процессы выветривания, такие как ветер, дождь и циклы замерзания/оттаивания, разбивают эти породы и минералы на более мелкие зерна.
Какова формула соли?
NaCl
Какова формула мела?
Карбонат кальция (мел) представляет собой химическое соединение с химической формулой CaCO3. Карбонат кальция (мел) представляет собой химическое соединение с химической формулой CaCO3.
Что такое формула пищевой соды?
NaHCO₃
Является ли мел смесью?
Ответ: Мел представляет собой соединение или смесь.
Является ли сухой лед смесью?
Сухой лед представляет собой соединение, состоящее из одной молекулы двуокиси углерода, химически связанной с двумя молекулами кислорода, а не элемент или смесь.
Является ли лед смесью?
Лед в воде Атомы воды распределены во льду иначе, чем в жидкой воде, и лед можно физически отделить от воды, сделав его смесью. Как только лед растает, их больше нельзя будет разделить, так что это уже не смесь.
Что такое элемент льда?
Ледяной элемент — это стихийный эффект, который может использоваться как охотниками, так и монстрами в нападении. Он использует сильный холод ветра и льда, чтобы ударить противников и нанести дополнительный урон.Элемент льда можно добавить в оружие, чтобы нанести дополнительный элементальный урон.
Является ли лед природным элементом?
В качестве природного кристаллического неорганического твердого вещества с упорядоченной структурой лед считается минералом. Он обладает правильной кристаллической структурой, основанной на молекуле воды, которая состоит из одного атома кислорода, ковалентно связанного с двумя атомами водорода, или Н-О-Н.
Он обладает правильной кристаллической структурой, основанной на молекуле воды, которая состоит из одного атома кислорода, ковалентно связанного с двумя атомами водорода, или Н-О-Н.
Является ли ледяная вода однородной?
б) Ледяная вода Однородная смесь – это образец вещества, состоящий из одной фазы.Все приведенные выше примеры являются гомогенными, за исключением ледяной воды, которая представляет собой гетерогенную смесь, поскольку в ней присутствуют как твердая, так и жидкая фазы.
Масло и вода однородны?
Чистое вещество или гомогенная смесь по определению состоят из одной фазы. Гетерогенная смесь состоит из двух или более фаз. Когда масло и вода смешиваются, они не смешиваются равномерно, а вместо этого образуют два отдельных слоя. Эта фаза будет однородной.
Является ли песок однородной смесью?
Песок может казаться однородным на расстоянии, но когда вы увеличиваете его, он оказывается неоднородным.Примеры гомогенных смесей включают воздух, солевой раствор, большинство сплавов и битум. Примеры гетерогенных смесей включают песок, масло и воду, а также куриный суп с лапшой.
Примеры гетерогенных смесей включают песок, масло и воду, а также куриный суп с лапшой.
Почему яблочный сок однородный?
Однородная смесь — это вещь, созданная из множества различных материалов, причина ее однородности в том, что ее разные части нельзя увидеть отдельно от всех остальных. Например, вода, яблочный сок или соль. поэтому это однородная смесь!
Является ли пищевая сода однородной смесью?
Бикарбонат натрия (название IUPAC: гидрокарбонат натрия), широко известный как пищевая сода, представляет собой химическое соединение с формулой NaHCO3.Это соль, состоящая из катиона натрия (Na+) и аниона бикарбоната (HCO3-). В зависимости от того, с кем вы разговариваете, гомогенные смеси могут считаться примерами чистых веществ.
Является ли сода смесью?
Раствор – это гомогенная смесь двух или более веществ. В растворе может быть только один растворитель, но растворенных веществ может быть много. Хорошим примером является газированная вода: растворителем является вода, а растворенными веществами являются углекислый газ, сахар, ароматизаторы, карамельный краситель и т. д.
д.
Является ли апельсиновый сок гомогенным или гетерогенным?
Поскольку его состав неоднороден, апельсиновый сок представляет собой неоднородную смесь.
Что за вещество такое молоко?
Молоко является примером гетерогенной смеси.
Химическая формула Название песка
Для песка не существует химической формулы. Например, химическое название NaCl — хлорид натрия, а его обычное название — соль.
Что такое химическая формула алмазов Quora
29102019 Ученые или химики определяют конкретное химическое соединение по его научному названию.
Название химической формулы песка .Кремнезем, который также называют кварцем, представляет собой тип минерала, который составляет большинство типов песка, таких как пляжный песок. Катион просто назван первым. Сколько граммов песка нужно для приготовления 180 м раствора.
Песок представляет собой смесь кремнезема SiO2 силиката кальция CaSiO4 нитрида кальция Ca3N2 нитрида кремния Si3N4. H Песок, содержащий большое количество минералов, таких как ильменит, цирконий, рутил, титан и т. д. Точечная обработка для высокой удерживающей способности.
H Песок, содержащий большое количество минералов, таких как ильменит, цирконий, рутил, титан и т. д. Точечная обработка для высокой удерживающей способности.
В песке этот кремнезем обычно присутствует в форме кварца.23062021 Поскольку все они содержат анион ОН, названия оснований оканчиваются на гидроксид. Соединение натрия Na и хлора Cl называется хлоридом натрия NaCl. В названии соединения элемент, стоящий слева в периодической таблице, используется первым.
Вопрос пользователя Wiki. C 12 H 22 O 11. Ca OH 2.
3-Пирролидинсульфокислота 1-3-2-5-азидо-2-нитробензоиламиноэтилдитио-1-оксопропокси-25-диокси-. 02042020 Химический состав песка состоит в основном из SiO2 или кремнезема.27072017 Диоксид кремния — это химическое название песка.
Песок представляет собой смесь нескольких различных минералов. Песок имеет разный цвет в зависимости от местоположения. Есть много типов песка, в зависимости от его составляющих.
Ацетат свинца гидратированный. 27032020 В нетропических странах основным компонентом песка является кремнезем, поэтому химическая формула песка — SiO2. Продолжайте повторять их, чтобы запомнить большую часть во время экзаменов.
Продолжайте повторять их, чтобы запомнить большую часть во время экзаменов.
С 6 Н 6 О.Сульфат магния Английская соль MgSO 4. Мел представляет собой карбонат кальция — CaCO3, песок бывает самого разного происхождения и.
В кремнеземе отношение числа атомов кремния к числу атомов кислорода равно 12. H 2 SO 4. Некоторые примеры названий и формул для оснований приведены в таблице ниже.
Подробная информация об общих названиях и химических названиях некоторых соединений, запрашиваемых на конкурсных экзаменах, таких как конкурсные экзамены. CH 3 COO 5. Сода кальцинированная стиральная Сода карбонат натрия.
03092012 Химическое название и формула ПЕСКА. Ответ пользователя Wiki 2012-09-03 221313. Na 3 PO 4.
Получите подробные иллюстрированные заметки, охватывающие весь учебный план. Но в целом они известны под своим общим названием, и многие из них являются частью нашей повседневной жизни. Серная кислота 98072 гмоль.
Распространенные и химические названия Стремитесь к успеху с материалом Doorsteptutor для пользовательского контента. 23102011 Химическая формула песка SiO_2. H 3 PO 4.
23102011 Химическая формула песка SiO_2. H 3 PO 4.
Каково химическое название мела и песка.Химическая формула песка — SiO2. Песок не растворяется в воде.
Сплав олова и сурьмы. В примере NaCl натрий находится в группе 1 в левой части таблицы, а хлор находится в группе 17 в правой части таблицы. На данный момент вы ознакомились с часто задаваемыми общими названиями некоторых важных химических соединений в SSC, а также в других конкурсных экзаменах.
По умолчанию формула песка рассматривается как sio2. 22022011 Химическая формула глауконита: K 008 R 1 133 R 2 067 Al 013 Si 387 O 10OH 2.И мусорные минералы, такие как магнетит и гранат.
Что такое химическая формула цемента Quora
Молекула кремнезема месяца Ноябрь 2013 Только HTML-версия
Химический состав образцов песка Скачать таблицу
Соединения сахара Что такое формула сахара Химическое название сахара
Что такое химическая формула стали Quora
Pin On Chemistry Worksheets
Pin On Chemistry Element
What Is The Chemical Formula Of Sand0 Quora
What Is The Chemical Formula Of Sand0
Чистый диоксид кремния из песка
Введение
Кварц — второй по распространенности минерал на поверхности нашей планеты. Это также кристаллическая форма диоксида кремния. Наиболее распространенным компонентом песка является кварц. В этом эксперименте мы возьмем песок, доступный каждому, и превратим его в чистый диоксид кремния, который можно будет использовать в будущих химических экспериментах.
Это также кристаллическая форма диоксида кремния. Наиболее распространенным компонентом песка является кварц. В этом эксперименте мы возьмем песок, доступный каждому, и превратим его в чистый диоксид кремния, который можно будет использовать в будущих химических экспериментах.
Реактивы
- Песок;
- Гидроксид натрия;
- Сильная кислота;
- Водопроводная вода;
Опасности
Этот эксперимент будет включать в себя сильный нагрев и расплавление гидроксида натрия.Расплавленный гидроксид натрия чрезвычайно агрессивен и очень опасен. При обращении с ним надевайте термоперчатки и защитные очки (в других ситуациях, не описанных здесь, при работе с расплавленным гидроксидом натрия необходимо использовать защитную маску). Указания по мерам безопасности будут подробно описаны на каждом этапе процедуры.
- Гидроксид натрия вызывает коррозию. Его предстоит переработать в больших количествах.
 Рекомендуются очки и перчатки.
Рекомендуются очки и перчатки. - В зависимости от выбранной кислоты могут потребоваться защитные очки и перчатки.
Процедура
Во-первых, песок, который будет использоваться, должен быть промыт (на самом деле, этот шаг необязателен, как описано в разделе «Теория»). Насыпьте около 300 г песка в стакан.
Заполните остальные стаканы водой.
Хорошо перемешать и декантировать. Повторите этот процесс не менее двух раз. Как только вы закончите, отложите сушиться.
Вам нужно подождать, пока песок не высохнет.
Для следующего шага вам понадобится какой-нибудь тигель.Он должен быть большим и, помните, будет грязным. Используйте то, что не жалко испортить. Я просто использую старую сковороду, которая у меня есть, для этого короля вещей. Он может быть грязным или ржавым, так как любые твердые загрязнения будут удалены позже.
Вот фото сковороды, которую я использую:
Алюминиевые кастрюли или тигли нельзя использовать , поскольку они реагируют с гидроксидом натрия.
В выбранный вами тигель добавьте высушенный песок (да, я потерял 15 грамм, высушивая его, точно не знаю как 😛 ).
Затем добавьте 155 г гидроксида натрия.
Вам понадобится 155 г гидроксида натрия. Следует носить перчатки и защитные очки.
Используйте ложку (или любой другой предмет), чтобы все перемешать. Важно хорошо перемешать реагенты.
Теперь идет нагревательная часть. Смесь необходимо нагреть не менее чем до 320ºC. Эта температура должна поддерживаться не менее 10 минут. Для этого я просто использовал старую печь.На самом деле, место, которое ты увидишь, — это моя испытательная площадка на предмет опасностей. Простите меня за уродство указанной печи:
Вы можете видеть пламя, которым я нагревал смесь. В этом нет ничего экстраординарного, и любая печь может достичь указанной температуры. Некоторые конфорки могут даже нагреваться до такой высокой температуры.
Если у вас нет термометра, чтобы проверить, есть ли у вас достаточно горячий источник тепла, вы можете использовать свинец. Свинец имеет температуру плавления 327,46ºC. Если вы можете расплавить свинец внутри своего тигля, тогда все в порядке.
Вот смесь через 1 минуту после начала нагрева:
Вот смесь через 10 минут после начала нагрева:
Вот смесь через 50 минут после начала нагрева:
Как видите, резкое различие в цвете. После того, как ваша смесь станет серовато-белой, дайте ей нагреться еще 10 минут. Затем возьмите его из отопления.
Когда смесь остынет, перелейте ее в химический стакан.
Примечание. При нагревании образуются очень мелкие сухие частицы, содержащие остатки гидроксида натрия.Если вы не будете осторожны при переносе порошка в стакан, эти частицы попадут в воздух, и вы, вероятно, вдохнете их (что сразу заметно из-за кашля и боли, которые он вызывает).
Наполните стакан водой и хорошо перемешайте.
Примечание: После добавления воды кажется, что серовато-белый порошок исчезает, и снова появляется песок. Это объясняется позже, в разделе «Теория».
Теперь настроена гравитационная фильтрация.Вы можете использовать вакуумную фильтрацию, если хотите, но я считаю это ненужным.
Перелейте раствор в бумажный фильтр, чтобы отфильтровать его.
Вот отфильтрованное решение:
Примечание: Вы, наверное, уже заметили, что я не использую лабораторную посуду для хранения раствора (только обычная банка). Следующим шагом будет изготовление кремниевой кислоты, которая прилипает ко всему. Кроме того, он легко разлагается на диоксид кремния.Когда он прилипает, его практически невозможно снять, не поцарапав стекло. Поэтому я рекомендую использовать стеклянную посуду, которую вы не боитесь испортить.
Итак, теперь вам нужно подкислить раствор, чтобы получить кремниевую кислоту. Я рекомендую использовать сильную кислоту, чтобы обеспечить полное преобразование в кремниевую кислоту. Это будет объяснено в разделе «Теория». Я решил использовать 100 мл 98% серной кислоты.
Я рекомендую использовать сильную кислоту, чтобы обеспечить полное преобразование в кремниевую кислоту. Это будет объяснено в разделе «Теория». Я решил использовать 100 мл 98% серной кислоты.
Поскольку реакция между раствором и серной кислотой очень бурная, мне пришлось прибегнуть к капельной воронке.
Это изображение после небольшого добавления серной кислоты:
Вот две фотографии банки после добавления всей Серной кислоты:
В результате этой реакции образуется какое-то странное вещество (кремниевая кислота), напоминающее желе. Это соединение необходимо очистить, прежде чем превратить его в конечный продукт (диоксид кремния).
Есть разные способы его очистки. Процесс, который я использую, быстр и прост в исполнении, но имеет тот недостаток, что часть продукта теряется.
Перед началом процесса возьмите еще один тигель (на этот раз вы должны использовать чистый). Это может быть что угодно, что может выдержать около 100ºC, и вы не возражаете против того, чтобы все запачкалось диоксидом кремния (не используйте лабораторное стекло, которое вам небезразлично). Я просто использовал алюминиевый горшок.
Я просто использовал алюминиевый горшок.
Позаботившись о тигле, возьмите химический стакан (теперь вы можете вернуться к лабораторной посуде) и наполните его наполовину водой.
Теперь возьмите ложку и наполните ложку желе:
Опустите ложку в стакан и взболтайте.Желе быстро опускается на дно стакана.
Повторите процесс еще раз. Я добавляю только две ложки на каждые 500 мл воды. После того, как вы добавили две ложки, слейте воду. Вы увидите, что только самые большие куски желе останутся на дне стакана. Я просто выбрасываю те, что сцеживаются вместе с водой (так при таком методе теряется некоторая часть продукта). Залейте водой, чтобы промыть желе, и снова сцедите.
Теперь положите этот промытый продукт в свой тигель.
Как только ваш продукт будет благополучно помещен в тигель, повторите весь процесс еще раз. Взять две ложки студня, добавить в 500 мл воды, сцедить, добавить еще 500 мл воды, сцедить и добавить промытый студень в тигель. Делайте это до тех пор, пока, очевидно, не останется желе для мытья.
Делайте это до тех пор, пока, очевидно, не останется желе для мытья.
Когда закончите, начните нагревать тигель. Мне просто нужно было нагреть мой около получаса. Как только все желе превратится в порошок, все готово.
Теперь у вас есть чистый диоксид кремния.Для дополнительной чистоты возьмите образовавшийся порошок диоксида кремния и несколько раз промойте его водой. Впрочем, если кисель был хорошо промыт, в этом нет необходимости.
Примечание. В конце эксперимента мне нравится взвешивать конечный продукт. На этот раз, после того как я сделал диоксид кремния, я сразу же использовал его для другого эксперимента и забыл взвесить конечный продукт. Как бы то ни было, я взвесил ту часть, которую отложил на потом.
Окончательный вес составил 135,9 г диоксида кремния (100 г, которые я уже использовал + 35,9, показанные на фотографиях).
Теория
В этом эксперименте есть много деталей, поэтому я сделаю все возможное, чтобы охватить их все.
Во-первых, зачем мыть песок? В этом нет необходимости. Однако я собрал свой песок в месте, обычно посещаемом кошками и собаками. Я не хотел, чтобы песок плохо пах в процессе нагрева, поэтому я промыл его, чтобы удалить мочу или экскременты.
Как уже говорилось, Песок, помимо прочего, состоит из кварца. Процентное содержание кварца в песке сильно различается.В среднем кварц составляет около 70% песка.
Кварц представляет собой кристаллическую форму диоксида кремния. Однако песок не подходит для химических экспериментов. Во-первых, потому что это всего 70% кварца (много примесей). Во-вторых, потому что кристаллы кварца часто заключают в себе примеси (поэтому многие из них окрашены).
Молярные массы
Гидроксид натрия: 39 997 г/моль
Диоксид кремния: 60,08 г/моль
Силикат натрия: 122,07 г/моль
В этом эксперименте я использовал гидроксид натрия для реакции с кварцем с образованием силиката натрия следующим образом:
2NaOH(ж) + SiO 2 (т) –> Na 2 SiO 3 (т) + H 2 O(г)
Как видите, 80 граммов гидроксида натрия реагируют с 60 граммами диоксида кремния.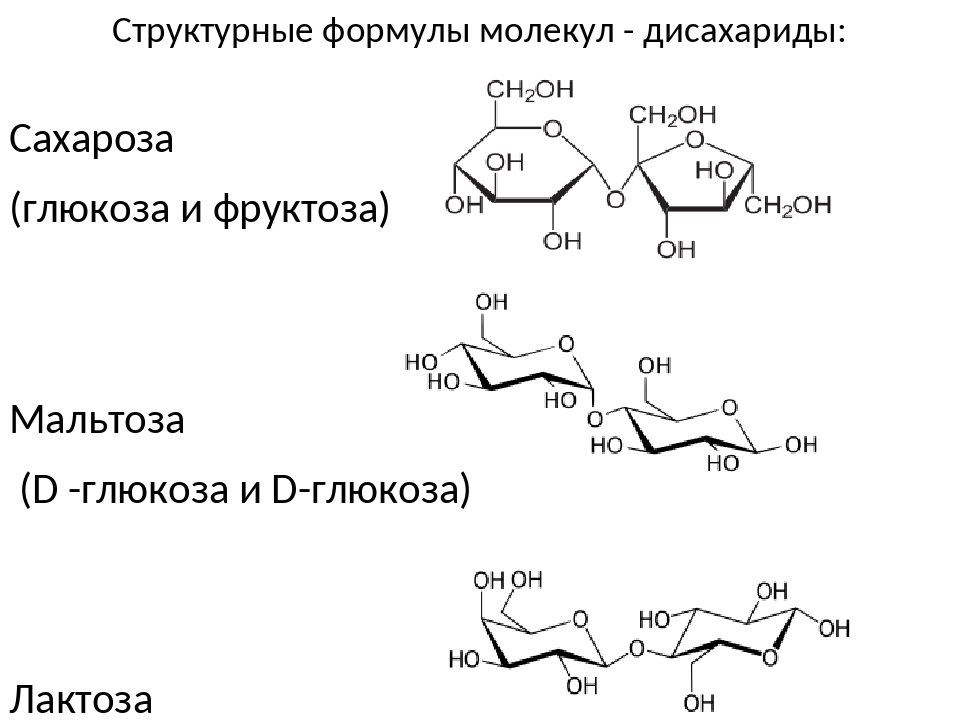 Я использовал 285 г песка. Однако песок состоит всего лишь на 70% из песка. Таким образом, только около 200 г этого песка было диоксидом кремния. Итак, 267 г гидроксида натрия реагируют с 200 г диоксида кремния. Однако я использовал только 155 г гидроксида натрия (около 60% от теоретического количества). Я сделал это, потому что не хотел тратить гидроксид натрия. Песок бесплатный, и вы можете легко получить его килограммами. Гидроксид натрия не так доступен, как песок. Мой песок может состоять из 60% диоксида кремния. Или 50%, если на то пошло. Использование всего 155 г гарантирует, что почти весь гидроксид натрия будет использован и ни один не будет потрачен впустую.
Я использовал 285 г песка. Однако песок состоит всего лишь на 70% из песка. Таким образом, только около 200 г этого песка было диоксидом кремния. Итак, 267 г гидроксида натрия реагируют с 200 г диоксида кремния. Однако я использовал только 155 г гидроксида натрия (около 60% от теоретического количества). Я сделал это, потому что не хотел тратить гидроксид натрия. Песок бесплатный, и вы можете легко получить его килограммами. Гидроксид натрия не так доступен, как песок. Мой песок может состоять из 60% диоксида кремния. Или 50%, если на то пошло. Использование всего 155 г гарантирует, что почти весь гидроксид натрия будет использован и ни один не будет потрачен впустую.
При расплавлении гидроксид натрия реагирует с кварцем (диоксидом кремния) с образованием силиката натрия и воды (пар). Гидроксид натрия плавится примерно при 318ºC. Поэтому в процессе я нагревал смесь до этой температуры. После плавления гидроксид натрия «покрывает» частицы песка, в результате чего смесь приобретает серовато-белый цвет. Образовавшийся силикат натрия также имеет белый цвет и образуется во внешней части каждой отдельной песчинки. Таким образом, все это становится белесым.
Образовавшийся силикат натрия также имеет белый цвет и образуется во внешней части каждой отдельной песчинки. Таким образом, все это становится белесым.
Насколько я знаю, единственным компонентом песка, который реагирует с гидроксидом натрия, является диоксид кремния.Однако, вероятно, есть еще несколько побочных реакций.
Силикат натрия растворим в воде. По завершении реакции к смеси добавляют воду для растворения силиката натрия. Любой оставшийся гидроксид натрия также растворяется. Вот почему песок «волшебным образом» снова появляется на этом этапе.
Следующим шагом было подкисление раствора. Силикат натрия реагирует с кислотами, образуя очень сложное соединение, известное как кремниевая кислота.
Поскольку было использовано 155 г гидроксида натрия, теоретическое количество силиката натрия в растворе (учитывая весь прореагировавший NaOH) составляет около 236 г.Подкисление силиката натрия очень сложно, и стехиометрически получить необходимое количество кислоты практически невозможно./chemical-formula-of-sugar-604003_FINAL-fc29035efa4a4e7d823fae1718488428.png) Опытным путем я обнаружил, что требуется около двух молей ионов гидроксония.
Опытным путем я обнаружил, что требуется около двух молей ионов гидроксония.
Итак, какую кислоту использовать? Перед добавлением кислоты у меня было около 800 мл раствора. 100 мл 98%-ной серной кислоты дали мне около 2 молей ионов гидроксония (ионов, отвечающих за образование кремниевой кислоты). Чтобы получить такое количество ионов гидроксония, мне понадобилось бы, например, 350 мл 33%-ной соляной кислоты.Это сделало бы слишком большой объем раствора / желе для работы. Однако, если серной кислоты нет, вы можете просто использовать соляную кислоту.
Наконец, все, что осталось сделать, это превратить кремниевую кислоту в диоксид кремния. Кремниевая кислота легко разлагается на аморфный диоксид кремния при умеренном нагревании.
Итак, подытожим:
Кварта (песок) –> Силикат натрия –> Кремниевая кислота –> Диоксид кремния
Заключительные примечания
Мне нравятся эксперименты такого типа, потому что они показывают, что можно превратить простые повседневные «химикаты», такие как песок, в полезные реагенты для любительской лаборатории. Надеюсь, вам понравилось чтение, и, пожалуйста, прокомментируйте и оставьте отзыв.
Надеюсь, вам понравилось чтение, и, пожалуйста, прокомментируйте и оставьте отзыв.
Нравится:
Нравится Загрузка…
Как производится силикон? — SIMTEC
ИЗ ЧЕГО СДЕЛАН СИЛИКОН?
Силикон — это универсальный полимер, используемый, среди прочего, в эластомерах, маслах, смазках и герметиках. Его основным ингредиентом является кремнезем — одна из наиболее часто встречающихся форм песка. Вот что вам нужно знать о производстве силикона.
В ЧЕМ РАЗНИЦА МЕЖДУ КРЕМНИЕМ И СИЛИКОНОМ
Одним из важных различий, когда речь идет о производстве силикона, является различие между силиконом и силиконом.Кремний — без буквы «е» — это химический элемент (Si). Как и большинство элементов, он не встречается в природе в изолированной форме. Силикон, однако, относится к широкому классу полимеров, которые состоят из силоксановой связи (химическая формула -Si-O-Si-) с различными присоединенными органическими соединениями.
ПОШАГОВОЕ РУКОВОДСТВО ПО ПРОИЗВОДСТВУ СИЛИКОНА
Выделение кремния из кремнезема является первым этапом производства силикона. Это делается путем нагревания большого объема кварцевого песка до температуры 1800°C.В результате получается чистый изолированный кремний, которому дают остыть, а затем измельчают в мелкий порошок.
Это делается путем нагревания большого объема кварцевого песка до температуры 1800°C.В результате получается чистый изолированный кремний, которому дают остыть, а затем измельчают в мелкий порошок.
Для получения силикона этот тонкий порошок кремния смешивают с метилхлоридом и снова нагревают. Тепло вызывает реакцию между двумя компонентами, образуя так называемый метилхлорсилан. Метилхлорсилан на самом деле представляет собой смесь, содержащую несколько соединений, наиболее преобладающим из которых является диметилдихлорсилан, который является основным строительным блоком силикона.
Для получения силикона из диметилдихлорсилана требуется сложный процесс дистилляции, в котором различные компоненты метилхлорсилана отделяются друг от друга.Поскольку разные хлорсиланы имеют разные температуры кипения, это можно сделать, нагревая смесь до ряда точных температур.
После перегонки к диметилдихлорсилану добавляют воду, в результате чего он разделяется на дисиланол и соляную кислоту. Затем соляная кислота действует как катализатор дисиланола, заставляя его конденсироваться в полидиметилсилоксан.
Затем соляная кислота действует как катализатор дисиланола, заставляя его конденсироваться в полидиметилсилоксан.
содержит силоксановую связь, которая является основой силикона.Оттуда силикон полимеризуется с использованием различных методов в зависимости от желаемых свойств конечного продукта.
Хотя производство силикона может показаться сложным, на самом деле это довольно просто и может производиться в массовом масштабе при относительно низких затратах. Поэтому неудивительно, что универсальный силикон стал одним из самых популярных эластомеров для коммерческого и промышленного использования.
СКАЧАТЬ НАШЕ БЕСПЛАТНОЕ РУКОВОДСТВО LSR
Химический эксперимент по извлечению соли из смеси | Образование
Химические смеси включают два или более элементов, не связанных химически, но находящихся в одном и том же физическом месте.Свойства элементов определяют, как их можно разделить, например, является ли какой-либо элемент растворимым, имеет магнитную восприимчивость или разделяется по цвету, вкусу или запаху. Соль растворима, что позволяет легко разделить смесь песка и соли.
Соль растворима, что позволяет легко разделить смесь песка и соли.
Подготовка к эксперименту
Соберите стеклянный стакан, воду, палочку для перемешивания, чашу для выпаривания, воронку, фильтровальную бумагу, бунзеновскую или спиртовую горелку, спички, металлическую сетку, металлическую подставку для приготовления пищи, стеклянную крышку чаши для выпаривания, щипцы, прихватки и Ваша смесь соли и песка.Чтобы определить процентное соотношение соли к песку, используйте весы, бумагу и письменные принадлежности, чтобы взвесить и записать вес пустой мензурки и общий вес чаши для выпаривания, крышки и палочки для перемешивания.
Первый этап
Поместите смесь в стеклянный стакан и добавьте в два раза больше дистиллированной воды по объему, чем у вас смесь песка и соли. Энергично перемешивайте смесь в течение пяти минут, чтобы соль полностью растворилась. Дайте стакану постоять, чтобы песок опустился на дно стакана.Как только песок осядет на дно, медленно вылейте воду из стакана через воронку, выстланную фильтровальной бумагой, в чашку для выпаривания, чтобы удалить остатки песка из воды.
Опреснение воды
Установите чашу для выпаривания поверх металлической сетки на подставке для приготовления пищи. Включите горелку и дайте воде закипеть и испариться из посуды. Когда соль начнет лопаться, осторожно наденьте щипцами стеклянную крышку на чашу для выпаривания, чтобы соль не высыпалась из чаши.Выключите горелку, когда соль перестанет взрываться, так как вся вода испарится, а соль останется кристаллизованной. Снимите блюдо с прихваткой и дайте ему остыть перед взвешиванием.
Удаление воды из песка
Если вы планируете рассчитать процентное содержание песка в соли, удалите воду из песка, нагревая песок таким же образом, как вы это делали с соленой водой. Используйте более низкое пламя с песком, так как для удаления воды потребуется меньше тепла. Как только песок станет сухим, выключите горелку и дайте стакану полностью остыть, прежде чем взвешивать его.
Определение процентного содержания смеси
Чтобы определить процентное содержание соли в песке, взвесьте чашку для выпаривания, накройте крышкой и снова перемешайте палочкой и вычтите вес пустых контейнеров из веса контейнеров после кристаллизации соли, чтобы получить вес соли. . Взвесьте стакан с сухим песком и вычтите из этого числа вес пустого стакана, чтобы получить вес песка. Добавьте груз песка и соли. Чтобы определить процентное содержание песка, разделите вес песка на вес смеси соли и песка и умножьте на 100.Если у вас есть 1,015 грамма песка, который вы отделили от 3,010 грамма смеси песка и соли, у вас получится смесь, состоящая из 33,72% песка.
. Взвесьте стакан с сухим песком и вычтите из этого числа вес пустого стакана, чтобы получить вес песка. Добавьте груз песка и соли. Чтобы определить процентное содержание песка, разделите вес песка на вес смеси соли и песка и умножьте на 100.Если у вас есть 1,015 грамма песка, который вы отделили от 3,010 грамма смеси песка и соли, у вас получится смесь, состоящая из 33,72% песка.
Ссылки
Писатель Био
Преподобная Кэтрин Рателифф Барр ведет занятия по рождению, воспитанию детей, вакцинации и альтернативной медицине с 1994 года. Она является пасторским семейным консультантом и воспитывала рожденных, приемных, усыновленных и приемных детей. Она имеет степень бакалавра английского языка и истории в Колледже Столетия Луизианы.Исследования включают акушерство, натуропатию и другие альтернативные методы лечения.
Песок | VWR
Положения и условия
Спасибо, что посетили наш сайт. Эти условия использования применимы к веб-сайтам США, Канады и Пуэрто-Рико (далее «Веб-сайт»), которыми управляет VWR («Компания»). Если вы заходите на веб-сайт из-за пределов США, Канады или Пуэрто-Рико, посетите соответствующий международный веб-сайт по адресу www.vwr.com, чтобы ознакомиться с применимыми положениями и условиями. Все пользователи веб-сайта подчиняются следующим условиям использования веб-сайта (эти «Условия использования»). Пожалуйста, внимательно прочтите эти Условия использования перед доступом или использованием любой части веб-сайта. Получая доступ к Веб-сайту или используя его, вы соглашаетесь с тем, что прочитали, поняли и согласны соблюдать настоящие Условия использования с периодическими изменениями, а также Политику конфиденциальности Компании, которая настоящим включена в настоящие Условия. использования. Если вы не хотите соглашаться с настоящими Условиями использования, не открывайте и не используйте какую-либо часть веб-сайта.
Если вы заходите на веб-сайт из-за пределов США, Канады или Пуэрто-Рико, посетите соответствующий международный веб-сайт по адресу www.vwr.com, чтобы ознакомиться с применимыми положениями и условиями. Все пользователи веб-сайта подчиняются следующим условиям использования веб-сайта (эти «Условия использования»). Пожалуйста, внимательно прочтите эти Условия использования перед доступом или использованием любой части веб-сайта. Получая доступ к Веб-сайту или используя его, вы соглашаетесь с тем, что прочитали, поняли и согласны соблюдать настоящие Условия использования с периодическими изменениями, а также Политику конфиденциальности Компании, которая настоящим включена в настоящие Условия. использования. Если вы не хотите соглашаться с настоящими Условиями использования, не открывайте и не используйте какую-либо часть веб-сайта.
Компания может пересматривать и обновлять настоящие Условия использования в любое время без предварительного уведомления, разместив измененные условия на веб-сайте. Продолжение использования вами веб-сайта означает, что вы принимаете и соглашаетесь с пересмотренными Условиями использования. Если вы не согласны с Условиями использования (в которые время от времени вносятся поправки) или недовольны Веб-сайтом, ваше единственное и исключительное средство правовой защиты — прекратить использование Веб-сайта.
Продолжение использования вами веб-сайта означает, что вы принимаете и соглашаетесь с пересмотренными Условиями использования. Если вы не согласны с Условиями использования (в которые время от времени вносятся поправки) или недовольны Веб-сайтом, ваше единственное и исключительное средство правовой защиты — прекратить использование Веб-сайта.
Использование на месте
Информация, содержащаяся на этом веб-сайте, предназначена только для информационных целей. Хотя считается, что информация верна на момент публикации, вам следует самостоятельно определить ее пригодность для вашего использования. Не все продукты или услуги, описанные на этом веб-сайте, доступны во всех юрисдикциях или для всех потенциальных клиентов, и ничто в настоящем документе не предназначено как предложение или ходатайство в какой-либо юрисдикции или какому-либо потенциальному покупателю, где такое предложение или продажа не соответствует требованиям.
Покупка товаров и услуг
Настоящие Условия и положения распространяются только на использование веб-сайта. Обратите внимание, что условия, касающиеся обслуживания, продаж продуктов, рекламных акций и других связанных мероприятий, можно найти по адресу https://us.vwr.com/store/content/externalContentPage.jsp?path=/en_US/about_vwr_terms_and_conditions.jsp , и эти условия регулируют любые покупки продуктов или услуг у Компании.
Обратите внимание, что условия, касающиеся обслуживания, продаж продуктов, рекламных акций и других связанных мероприятий, можно найти по адресу https://us.vwr.com/store/content/externalContentPage.jsp?path=/en_US/about_vwr_terms_and_conditions.jsp , и эти условия регулируют любые покупки продуктов или услуг у Компании.
Интерактивные функции
Веб-сайт может содержать службы досок объявлений, области чата, группы новостей, форумы, сообщества, личные веб-страницы, календари и / или другие средства сообщения или коммуникации, предназначенные для того, чтобы вы могли общаться с общественностью в целом или с группой ( вместе «Функция сообщества»).Вы соглашаетесь использовать функцию сообщества только для публикации, отправки и получения сообщений и материалов, которые являются надлежащими и относятся к конкретной функции сообщества. Вы соглашаетесь использовать веб-сайт только в законных целях.
A. В частности, вы соглашаетесь не делать ничего из следующего при использовании функции сообщества:
1.
Оскорблять, оскорблять, преследовать, преследовать, угрожать или иным образом нарушать законные права (например, право на неприкосновенность частной жизни и гласность) других.
2. Публиковать, публиковать, загружать, распространять или распространять любые неуместные, богохульные, клеветнические, нарушающие авторские права, непристойные, непристойные или незаконные темы, имена, материалы или информацию.
3. Загружать файлы, содержащие программное обеспечение или другие материалы, защищенные законами об интеллектуальной собственности (или правами на неприкосновенность частной жизни или публичное использование), за исключением случаев, когда вы владеете или контролируете права на них или получили все необходимые согласия.
4. Загружать файлы, содержащие вирусы, поврежденные файлы или любое другое подобное программное обеспечение или программы, которые могут нарушить работу чужого компьютера.
5. Перехват или попытка перехвата электронной почты, не предназначенной для вас.
6. Рекламировать или предлагать продать или купить какие-либо товары или услуги для любых деловых целей, если такая Функция сообщества специально не разрешает такие сообщения.
7. Проводить или рассылать опросы, конкурсы, финансовые пирамиды или письма счастья.
8. Загружайте любой файл, опубликованный другим пользователем Элемента сообщества, который, как вы знаете или должны были бы знать, не может быть законно распространен таким образом или что у вас есть договорные обязательства по сохранению конфиденциальности (несмотря на его доступность на веб-сайте).
9. Фальсифицировать или удалять любые указания на авторство, юридические или другие надлежащие уведомления, обозначения прав собственности или ярлыки происхождения или источника программного обеспечения или других материалов, содержащихся в загружаемом файле.
10. Искажать связь с каким-либо лицом или организацией.
11. Участвовать в любых других действиях, которые ограничивают или препятствуют чьему-либо использованию Веб-сайта или которые, по мнению Компании, могут нанести вред Компании или пользователям Веб-сайта или привлечь их к ответственности.
12. Нарушать любые применимые законы или правила или нарушать любой кодекс поведения или другие правила, которые могут применяться к какой-либо конкретной функции сообщества.
13. Собирать или иным образом собирать информацию о других, включая адреса электронной почты, без их согласия.
B. Вы понимаете и признаете, что несете ответственность за любой контент, который вы отправляете, вы, а не Компания, несете полную ответственность за такой контент, включая его законность, надежность и уместность. Если вы публикуете сообщения от имени или от имени вашего работодателя или другого юридического лица, вы заявляете и гарантируете, что у вас есть на это право. Загружая или иным образом передавая материалы в любую область веб-сайта, вы гарантируете, что эти материалы являются вашими собственными или находятся в общественном достоянии или иным образом свободны от проприетарных или иных ограничений, и что вы имеете право размещать их на веб-сайте.
Кроме того, загружая или иным образом передавая материал в любую область веб-сайта, вы предоставляете Компании безотзывное, бесплатное право во всем мире на публикацию, воспроизведение, использование, адаптацию, редактирование и / или изменение таких материалов любым способом, в любые и все средства массовой информации, известные в настоящее время или обнаруженные в будущем во всем мире, в том числе в Интернете и World Wide Web, для рекламных, коммерческих, торговых и рекламных целей, без дополнительных ограничений или компенсации, если это не запрещено законом, и без уведомления, проверки или одобрения.
C. Компания оставляет за собой право, но не принимает на себя никакой ответственности (1) удалить любые материалы, размещенные на веб-сайте, которые Компания по своему собственному усмотрению сочтет несовместимыми с вышеуказанными обязательствами или иным образом неприемлемыми по любой причине. ; и (2) прекратить доступ любого пользователя ко всему или к части веб-сайта.
Однако Компания не может ни просмотреть все материалы до их размещения на веб-сайте, ни обеспечить быстрое удаление нежелательных материалов после их размещения.Соответственно, Компания не несет ответственности за какие-либо действия или бездействие в отношении передач, сообщений или контента, предоставленных третьими сторонами. Компания оставляет за собой право предпринимать любые действия, которые она сочтет необходимыми для защиты личной безопасности пользователей этого веб-сайта и общественности; тем не менее, Компания не несет ответственности перед кем-либо за выполнение или невыполнение действий, описанных в этом параграфе.
D. Несоблюдение вами положений пунктов (A) или (B) выше может привести к прекращению вашего доступа к веб-сайту и может повлечь за собой гражданскую и / или уголовную ответственность.
Особое примечание о материалах сообщества
Любой контент и/или мнения, загруженные, выраженные или отправленные через любую функцию сообщества или любой другой общедоступный раздел веб-сайта (включая защищенные паролем области), а также все статьи и ответы на вопросы, кроме контента, явно разрешенного Компании, являются исключительно мнением и ответственностью физического или юридического лица, представляющего их, и не обязательно отражают мнение Компании. Например, любое рекомендованное или предлагаемое использование продуктов или услуг, доступных от Компании, которое публикуется через функцию сообщества, не является признаком одобрения или рекомендации со стороны Компании. Если вы решите следовать какой-либо такой рекомендации, вы делаете это на свой страх и риск.
Например, любое рекомендованное или предлагаемое использование продуктов или услуг, доступных от Компании, которое публикуется через функцию сообщества, не является признаком одобрения или рекомендации со стороны Компании. Если вы решите следовать какой-либо такой рекомендации, вы делаете это на свой страх и риск.
Ссылки на сторонние сайты
Веб-сайт может содержать ссылки на другие веб-сайты в Интернете. Компания не несет ответственности за контент, продукты, услуги или методы любых сторонних веб-сайтов, включая, помимо прочего, сайты, на которые есть ссылки на Веб-сайт или с него, сайты, созданные внутри Веб-сайта, или стороннюю рекламу, и не делает заявлений относительно их качество, содержание или точность.Наличие ссылок с веб-сайта на любой сторонний веб-сайт не означает, что мы одобряем, поддерживаем или рекомендуем этот веб-сайт. Мы отказываемся от всех гарантий, явных или подразумеваемых, в отношении точности, законности, надежности или действительности любого контента на любых сторонних веб-сайтах.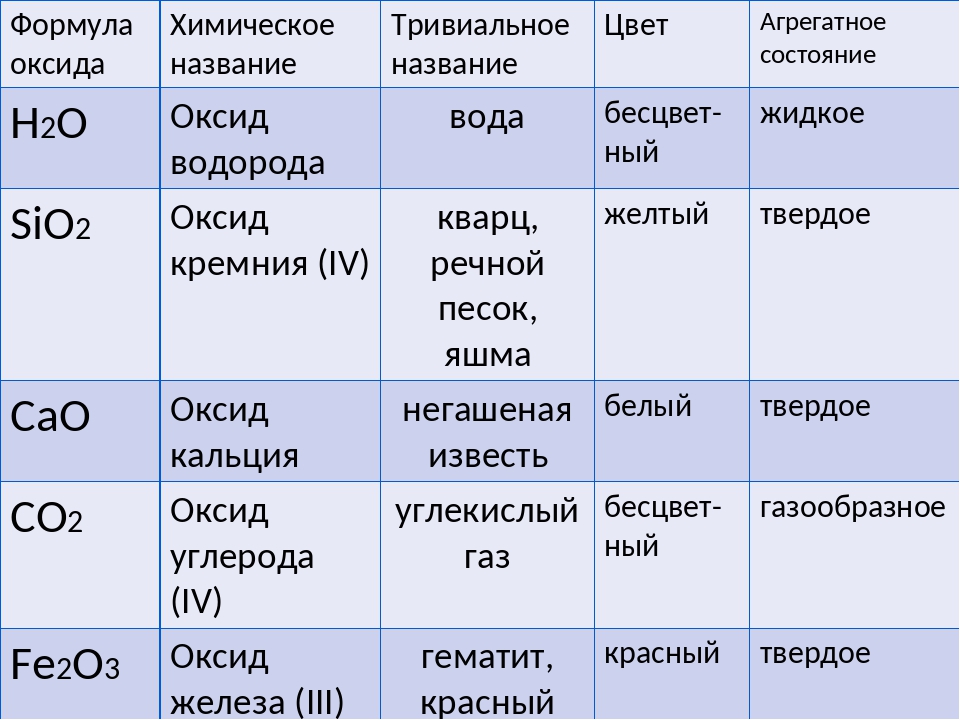 Вы используете сторонние веб-сайты на свой страх и риск и в соответствии с условиями использования таких веб-сайтов.
Вы используете сторонние веб-сайты на свой страх и риск и в соответствии с условиями использования таких веб-сайтов.
Права собственности на контент
Вы признаете и соглашаетесь с тем, что все содержимое Веб-сайта (включая всю информацию, данные, программное обеспечение, графику, текст, изображения, логотипы и/или другие материалы), а также его дизайн, выбор, сбор, размещение и сборка являются являются собственностью Компании и защищены законами США и международными законами об интеллектуальной собственности.Вы имеете право использовать содержимое веб-сайта только в личных целях или в законных деловых целях. Вы не можете копировать, изменять, создавать производные работы, публично демонстрировать или исполнять, переиздавать, хранить, передавать, распространять, удалять, удалять, дополнять, добавлять, участвовать в передаче, лицензировать или продавать какие-либо материалы в Интернете. Сайт без предварительного письменного согласия Компании, за исключением: (а) временного хранения копий таких материалов в ОЗУ, (б) хранения файлов, которые автоматически кэшируются вашим веб-браузером для улучшения отображения, и (в) печати разумного количество страниц веб-сайта; в каждом случае при условии, что вы не изменяете и не удаляете какие-либо уведомления об авторских правах или других правах собственности, включенные в такие материалы. Ни название, ни какие-либо права интеллектуальной собственности на любую информацию или материалы на веб-сайте не передаются вам, а остаются за Компанией или соответствующим владельцем такого контента.
Ни название, ни какие-либо права интеллектуальной собственности на любую информацию или материалы на веб-сайте не передаются вам, а остаются за Компанией или соответствующим владельцем такого контента.
Товарные знаки
Название и логотип Компании, а также все соответствующие названия, логотипы, названия продуктов и услуг, встречающиеся на Веб-сайте, являются товарными знаками Компании и/или соответствующих сторонних поставщиков. Их нельзя использовать или повторно отображать без предварительного письменного согласия Компании.
Отказ от ответственности
Компания не несет никакой ответственности за материалы, информацию и мнения, представленные на Веб-сайте или доступные через него («Контент сайта»). Вы полагаетесь на Контент сайта исключительно на свой страх и риск. Компания не несет никакой ответственности за травмы или убытки, возникшие в результате использования любого Контента Сайта.
ВЕБ-САЙТ, СОДЕРЖИМОЕ САЙТА, ПРОДУКТЫ И УСЛУГИ, ПРЕДОСТАВЛЯЕМЫЕ НА ВЕБ-САЙТЕ ИЛИ ДОСТУПНЫЕ ЧЕРЕЗ ЕГО, ПРЕДОСТАВЛЯЮТСЯ НА УСЛОВИЯХ «КАК ЕСТЬ» И «КАК ДОСТУПНО», СО ВСЕМИ ОШИБКАМИ.КОМПАНИЯ И НИ ЛИБО, СВЯЗАННОЕ С КОМПАНИЕЙ, НЕ ДАЕТ НИКАКИХ ГАРАНТИЙ ИЛИ ЗАЯВЛЕНИЙ В ОТНОШЕНИИ КАЧЕСТВА, ТОЧНОСТИ ИЛИ ДОСТУПНОСТИ ВЕБ-САЙТА. В частности, НО БЕЗ ОГРАНИЧЕНИЙ ВЫШЕГО, НИ КОМПАНИЯ И НИ ЛИБО, СВЯЗАННОЕ С КОМПАНИЕЙ, НЕ ГАРАНТИРУЕТ ИЛИ ЗАЯВЛЯЕТ, ЧТО ВЕБ-САЙТ, СОДЕРЖАНИЕ САЙТА ИЛИ УСЛУГИ, ПРЕДОСТАВЛЯЕМЫЕ НА САЙТЕ ИЛИ ЧЕРЕЗ САЙТ, БУДУТ ТОЧНЫМИ, НАДЕЖНЫМИ ИЛИ БЕСПЛАТНЫМИ ЧТО ДЕФЕКТЫ БУДУТ ИСПРАВЛЕНЫ; ЧТО ВЕБ-САЙТ ИЛИ СЕРВЕР, ДЕЛАЮЩИЙ ЕГО ДОСТУПНЫМ, СВОБОДНЫ ОТ ВИРУСОВ ИЛИ ДРУГИХ ВРЕДНЫХ КОМПОНЕНТОВ; ИЛИ ЧТО ВЕБ-САЙТ ИНАЧЕ ОТВЕЧАЕТ ВАШИМ ПОТРЕБНОСТЯМ ИЛИ ОЖИДАНИЯМ.КОМПАНИЯ ОТКАЗЫВАЕТСЯ ОТ ВСЕХ ГАРАНТИЙ, ЯВНЫХ ИЛИ ПОДРАЗУМЕВАЕМЫХ, ВКЛЮЧАЯ ЛЮБЫЕ ГАРАНТИИ КОММЕРЧЕСКОЙ ЦЕННОСТИ, ПРИГОДНОСТИ ДЛЯ ОПРЕДЕЛЕННОЙ ЦЕЛИ И НЕ НАРУШЕНИЯ.
НИ ПРИ КАКИХ ОБСТОЯТЕЛЬСТВАХ КОМПАНИЯ, ЕЕ ЛИЦЕНЗИАРЫ ИЛИ ПОДРЯДЧИКИ НЕ НЕСУТ ОТВЕТСТВЕННОСТИ ЗА ЛЮБОЙ УЩЕРБ ЛЮБОГО РОДА, ПО ЛЮБОЙ ПРАВОВОЙ ТЕОРИИ, ВЫТЕКАЮЩИЙ ИЗ ИЛИ В СВЯЗИ С ИСПОЛЬЗОВАНИЕМ ВАМИ ИЛИ НЕВОЗМОЖНОСТЬЮ ИСПОЛЬЗОВАНИЯ ВЕБ-САЙТА, СОДЕРЖИМОГО САЙТА, ЛЮБЫЕ УСЛУГИ, ПРЕДОСТАВЛЯЕМЫЕ НА ИЛИ ЧЕРЕЗ ВЕБ-САЙТ ИЛИ ЛЮБОЙ ССЫЛОЧНЫЙ САЙТ, ВКЛЮЧАЯ ЛЮБЫЕ ПРЯМЫЕ, КОСВЕННЫЕ, СЛУЧАЙНЫЕ, ОСОБЫЕ, КОСВЕННЫЕ ИЛИ ШТРАФНЫЕ УБЫТКИ, ВКЛЮЧАЯ, ПОМИМО ПРОЧЕГО, ТРАВМЫ, УПУЩЕННУЮ ПРИБЫЛЬ ИЛИ УЩЕРБ В РЕЗУЛЬТАТЕ ЗАДЕРЖКИ, ПЕРЕРЫВА В ОБСЛУЖИВАНИИ , ВИРУСЫ, УДАЛЕНИЕ ФАЙЛОВ ИЛИ ЭЛЕКТРОННЫХ СООБЩЕНИЙ, ИЛИ ОШИБКИ, УПУЩЕНИЯ ИЛИ ДРУГИЕ НЕТОЧНОСТИ НА ВЕБ-САЙТЕ ИЛИ СОДЕРЖИМОМ САЙТА ИЛИ УСЛУГАХ, НЕЗАВИСИМО ОТ НЕБРЕЖНОСТИ СО СТОРОНЫ КОМПАНИИ И БЫЛА ИЛИ НЕ УВЕДОМЛЕНА КОМПАНИЯ О ВОЗМОЖНОСТИ ЛЮБОЙ ТАКОЙ УЩЕРБ, ЕСЛИ НЕ ЗАПРЕЩЕНО ПРИМЕНИМЫМ ЗАКОНОДАТЕЛЬСТВОМ.
Возмещение ущерба
Вы соглашаетесь возместить убытки и ограждать Компанию и ее должностных лиц, директоров, агентов, сотрудников и других лиц, связанных с Веб-сайтом, от любых и всех обязательств, расходов, убытков и издержек, включая разумные гонорары адвокатов, возникающие в результате любое нарушение вами настоящих Условий использования, использование вами веб-сайта или любых продуктов, услуг или информации, полученных с веб-сайта или через него, ваше подключение к веб-сайту, любой контент, который вы отправляете на веб-сайт через любую Функция сообщества или нарушение вами каких-либо прав другого лица.
Применимое законодательство; Международное использование
Настоящие условия регулируются и толкуются в соответствии с законами штата Пенсильвания без учета каких-либо принципов коллизионного права. Вы соглашаетесь с тем, что любые судебные иски или иски, вытекающие из настоящих Условий использования или связанные с ними, будут подаваться исключительно в суды штата или федеральные суды, расположенные в Пенсильвании, и вы тем самым соглашаетесь и подчиняетесь личной юрисдикции таких судов для цели судебного разбирательства по любому подобному действию.
Настоящие Условия использования применимы к пользователям в США, Канаде и Пуэрто-Рико. Если вы заходите на веб-сайт из-за пределов США, Канады или Пуэрто-Рико, пожалуйста, посетите соответствующий международный веб-сайт, доступный по адресу www.vwr.com, для ознакомления с применимыми условиями. Если вы решите получить доступ к этому веб-сайту из-за пределов указанных юрисдикций, а не использовать доступные международные сайты, вы соглашаетесь с настоящими Условиями использования и тем, что такие условия будут регулироваться и толковаться в соответствии с законами США и штата. Пенсильвании и что мы не делаем никаких заявлений о том, что материалы или услуги на этом веб-сайте подходят или доступны для использования в этих других юрисдикциях.В любом случае все пользователи несут ответственность за соблюдение местных законов.
Общие условия
Настоящие Условия использования, в которые время от времени могут вноситься поправки, представляют собой полное соглашение и понимание между вами и нами, регулирующее использование вами Веб-сайта. Наша неспособность реализовать или обеспечить соблюдение какого-либо права или положения Условий использования не означает отказ от такого права или положения. Если какое-либо положение Условий использования будет признано судом компетентной юрисдикции недействительным, вы, тем не менее, соглашаетесь с тем, что суд должен попытаться реализовать намерения сторон, отраженные в этом положении и других положениях Положения и условия использования остаются в полной силе.Ни ваши деловые отношения, ни поведение между вами и Компанией, ни какая-либо торговая практика не может считаться изменением настоящих Условий использования. Вы соглашаетесь с тем, что независимо от какого-либо закона или закона об обратном, любые претензии или основания для иска, возникающие из или связанные с использованием Сайта или Условий использования, должны быть поданы в течение одного (1) года после такой претензии или причины. иска возникла или будет навсегда запрещена. Любые права, прямо не предоставленные в настоящем документе, сохраняются за Компанией.
Наша неспособность реализовать или обеспечить соблюдение какого-либо права или положения Условий использования не означает отказ от такого права или положения. Если какое-либо положение Условий использования будет признано судом компетентной юрисдикции недействительным, вы, тем не менее, соглашаетесь с тем, что суд должен попытаться реализовать намерения сторон, отраженные в этом положении и других положениях Положения и условия использования остаются в полной силе.Ни ваши деловые отношения, ни поведение между вами и Компанией, ни какая-либо торговая практика не может считаться изменением настоящих Условий использования. Вы соглашаетесь с тем, что независимо от какого-либо закона или закона об обратном, любые претензии или основания для иска, возникающие из или связанные с использованием Сайта или Условий использования, должны быть поданы в течение одного (1) года после такой претензии или причины. иска возникла или будет навсегда запрещена. Любые права, прямо не предоставленные в настоящем документе, сохраняются за Компанией. Мы можем прекратить ваш доступ или приостановить доступ любого пользователя ко всему сайту или его части без предварительного уведомления за любое поведение, которое мы, по нашему собственному усмотрению, считаем нарушением любого применимого законодательства или наносящим ущерб интересам другого пользователя. , стороннего поставщика, поставщика услуг или нас. Любые вопросы, касающиеся настоящих Условий использования, следует направлять по адресу [email protected].
Мы можем прекратить ваш доступ или приостановить доступ любого пользователя ко всему сайту или его части без предварительного уведомления за любое поведение, которое мы, по нашему собственному усмотрению, считаем нарушением любого применимого законодательства или наносящим ущерб интересам другого пользователя. , стороннего поставщика, поставщика услуг или нас. Любые вопросы, касающиеся настоящих Условий использования, следует направлять по адресу [email protected].
Жалобы на нарушение авторских прав
Мы уважаем чужую интеллектуальную собственность и просим наших пользователей делать то же самое.Если вы считаете, что ваша работа была скопирована и доступна на Сайте таким образом, что это представляет собой нарушение авторских прав, вы можете уведомить нас, предоставив нашему агенту по авторским правам следующую информацию:
электронная или физическая подпись лица, уполномоченного действовать от имени правообладателя;
описание работы, защищенной авторским правом, в отношении которой были нарушены ваши претензии;
идентификация URL-адреса или другого конкретного места на Сайте, где находится материал, который, по вашему мнению, нарушает авторские права;
ваш адрес, номер телефона и адрес электронной почты;
ваше заявление о том, что вы добросовестно полагаете, что спорное использование не разрешено владельцем авторских прав, его агентом или законом; и
ваше заявление, сделанное под страхом наказания за лжесвидетельство, о том, что приведенная выше информация в вашем уведомлении является точной и что вы являетесь владельцем авторских прав или уполномочены действовать от имени владельца авторских прав.


 Вплоть до температуры +550 градусов по Цельсию он никак не изменяется. О том, какие свойства песка проявляются выше данного показателя, могут сказать стеклодувы, так как именно этот материал применяется для создания любых стекол.
Вплоть до температуры +550 градусов по Цельсию он никак не изменяется. О том, какие свойства песка проявляются выше данного показателя, могут сказать стеклодувы, так как именно этот материал применяется для создания любых стекол._Chemical_Structure.jpg-650.jpg)
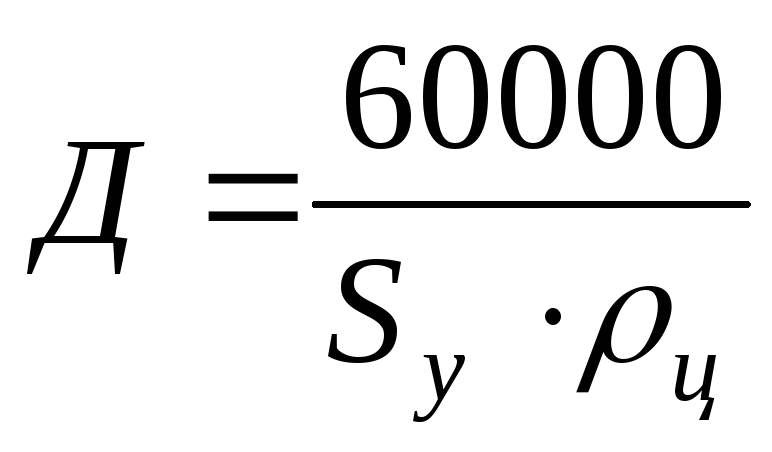 ) + H2O = Na2SiO3 + 2H2 ↑
) + H2O = Na2SiO3 + 2H2 ↑ Простые
Простые Окси
Окси .
. Рекомендуются очки и перчатки.
Рекомендуются очки и перчатки.
 Если у вас нет термометра, чтобы проверить, есть ли у вас достаточно горячий источник тепла, вы можете использовать свинец. Свинец имеет температуру плавления 327,46ºC. Если вы можете расплавить свинец внутри своего тигля, тогда все в порядке.
Если у вас нет термометра, чтобы проверить, есть ли у вас достаточно горячий источник тепла, вы можете использовать свинец. Свинец имеет температуру плавления 327,46ºC. Если вы можете расплавить свинец внутри своего тигля, тогда все в порядке.
 Оскорблять, оскорблять, преследовать, преследовать, угрожать или иным образом нарушать законные права (например, право на неприкосновенность частной жизни и гласность) других.
Оскорблять, оскорблять, преследовать, преследовать, угрожать или иным образом нарушать законные права (например, право на неприкосновенность частной жизни и гласность) других. 
 Кроме того, загружая или иным образом передавая материал в любую область веб-сайта, вы предоставляете Компании безотзывное, бесплатное право во всем мире на публикацию, воспроизведение, использование, адаптацию, редактирование и / или изменение таких материалов любым способом, в любые и все средства массовой информации, известные в настоящее время или обнаруженные в будущем во всем мире, в том числе в Интернете и World Wide Web, для рекламных, коммерческих, торговых и рекламных целей, без дополнительных ограничений или компенсации, если это не запрещено законом, и без уведомления, проверки или одобрения.
Кроме того, загружая или иным образом передавая материал в любую область веб-сайта, вы предоставляете Компании безотзывное, бесплатное право во всем мире на публикацию, воспроизведение, использование, адаптацию, редактирование и / или изменение таких материалов любым способом, в любые и все средства массовой информации, известные в настоящее время или обнаруженные в будущем во всем мире, в том числе в Интернете и World Wide Web, для рекламных, коммерческих, торговых и рекламных целей, без дополнительных ограничений или компенсации, если это не запрещено законом, и без уведомления, проверки или одобрения. Однако Компания не может ни просмотреть все материалы до их размещения на веб-сайте, ни обеспечить быстрое удаление нежелательных материалов после их размещения.Соответственно, Компания не несет ответственности за какие-либо действия или бездействие в отношении передач, сообщений или контента, предоставленных третьими сторонами. Компания оставляет за собой право предпринимать любые действия, которые она сочтет необходимыми для защиты личной безопасности пользователей этого веб-сайта и общественности; тем не менее, Компания не несет ответственности перед кем-либо за выполнение или невыполнение действий, описанных в этом параграфе.
Однако Компания не может ни просмотреть все материалы до их размещения на веб-сайте, ни обеспечить быстрое удаление нежелательных материалов после их размещения.Соответственно, Компания не несет ответственности за какие-либо действия или бездействие в отношении передач, сообщений или контента, предоставленных третьими сторонами. Компания оставляет за собой право предпринимать любые действия, которые она сочтет необходимыми для защиты личной безопасности пользователей этого веб-сайта и общественности; тем не менее, Компания не несет ответственности перед кем-либо за выполнение или невыполнение действий, описанных в этом параграфе.